Last update: 3 sierpnia 2015
Wprowadzenie
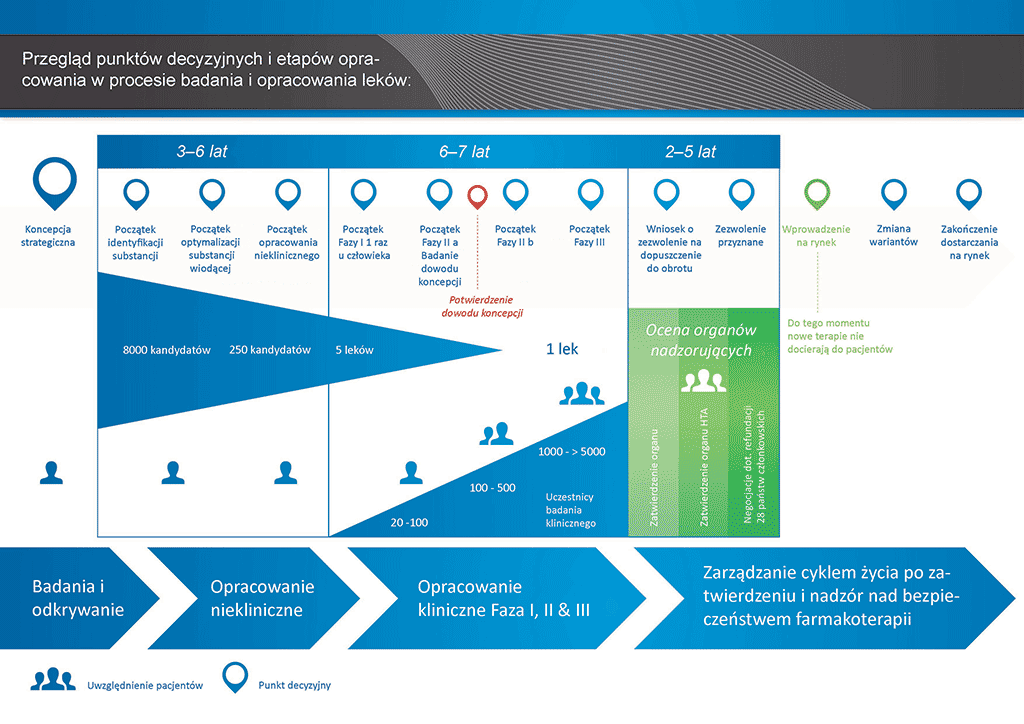
Przeprowadzenie wszystkich badań i prac koniecznych do wprowadzenia nowego leku na rynek zajmuje ponad 12 lat i kosztuje średnio ponad 1 mld euro.
Odkrywanie nowych leków jest przedsięwzięciem o wysokim ryzyku. Większość (około 98%) opracowywanych substancji nie trafia na rynek w postaci nowych leków. Zwykle powodem tego jest fakt, że korzyści i ryzyko (negatywne działania niepożądane) ujawniane w procesie rozwoju nie wytrzymują porównania z lekami już dostępnymi dla pacjentów.
Opracowanie nowego leku można podzielić na 10 etapów. Ten artykuł dotyczy etapu 6: badania typu „Proof of Mechanism” — badania kliniczne Fazy I
- Proces opracowania leku zajmuje ponad dziesięć lat planowania i badań pozwalających przejść od cząsteczki do dostępnego na rynku leczenia.
Etap 6: badania typu „Proof of Mechanism” — badania kliniczne Fazy I
Decyzja o rozpoczęciu pierwszego badania klinicznego jest najważniejsza. W trakcie prac badawczych nad cząsteczką „kandydującą” rośnie liczba, koszty i złożoność podejmowanych w tym procesie działań.
Przed rozpoczęciem badania klinicznego należy przesłać wniosek o zgodę na rozpoczęcie badania klinicznego (CTA, Clinical Trial Application). CTA musi zawierać następujące ważne dokumenty:
- Dokumentację rejestracyjną produktu leczniczego (IMPD, Investigational Medicinal Product Dossier), w tym ADME i badania obserwacyjne działania (w miejscu docelowym), informacje o toksyczności oraz o produkcji leku.
- Protokół badania, opisujący szczegółowo prowadzenie badania i ocenę wyników.
- Broszurę Badacza (IB, Investigator’s Brochure), zawierającą skrót informacji umożliwiający lekarzom prowadzącym badanie (badaczom) zrozumienie działania leku na organizm (farmakologii). Dzięki temu badacze mogą udzielać ochotnikom i pacjentom wyjaśnień na temat badania i uzyskiwać świadomą zgodę (patrz niżej).
CTA należy przesłać do zatwierdzenia do właściwego organu krajowego. W trakcie procesu uzyskuje się także opinię Komisji Bioetycznej.
Najwyższym priorytetem jest bezpieczeństwo, toteż badania z udziałem ludzi nie mogą się rozpocząć bez uzyskania zgody wewnętrznej komisji kwalifikacyjnej (w firmie), zewnętrznej Komisji Bioetycznej i zewnętrznego organu nadzorującego.
Badanie z udziałem ochotników (określane także jako badanie eksploracyjne, badanie typu „Proof of mechanism” lub badanie Fazy I)
To badanie pozwala lekarzom i naukowcom określić, czy lek jest bezpieczny dla ludzi. Umożliwia także stwierdzenie, czy zachowanie leku u ludzi jest takie samo jak w przypadku zwierząt. Badania te dostarczają informacji na temat sposobu działania leku — określanego jako „mechanizm działania”. Celem badań jest także znalezienie dodatkowych działań leku.
W badaniach klinicznych Fazy 1 bierze udział od 20 do 100 ochotników. Zwykle prowadzi się je w specjalnych placówkach Fazy 1, w których także rekrutuje się ochotników. Lekarze wykonujący takie badania są nazywani badaczami. Mają kwalifikacje do przeprowadzania badań klinicznych w celu określenia wyniku badania.
Pierwsze badanie kliniczne zwykle obejmuje zdrowych ochotników płci męskiej. Szczegółowe informacje na temat badania klinicznego muszą zostać przedstawione w Protokole badania i muszą zawierać:
- kontekst choroby (opis „niezrealizowanej potrzeby”),
- informacje niekliniczne,
- szczegółowe informacje na temat badania klinicznego (co i kiedy będzie wykonywane) oraz
- sposób używania i analizowania informacji.
Wszystkie informacje dotyczące badania są gromadzone w dokumencie o nazwie Karta Obserwacji Klinicznej (CRF, Case Record Form).
Dokument ten zawiera także liczne wskazówki i przepisy określane wspólnie jako Dobra Praktyka Kliniczna mająca chronić bezpieczeństwo uczestników badania.
Protokół badania zawiera także część dotyczącą statystyki poświęconą testom statystycznym służącym do analizowania wyników. Odpowiednie decyzje muszą zostać podjęte przed rozpoczęciem badania, aby było wiadomo, jak informacje zostaną uzyskane i jak będą użyte po zakończeniu badania.
Dwa niezwykle ważne elementy to:
- Świadoma zgoda (zapewniająca, że uczestnicy rozumieją, co będzie miało miejsce, i zgadzają się na uczestnictwo w badaniu) oraz
- ocena i opinia Komisji Bioetycznej.
Komisja Bioetyczna jest niezależnym ciałem składającym się z lekarzy, naukowców, pielęgniarek i osób niezwiązanych z naukami medycznymi. Przed rozpoczęciem badania komisja sprawdza Protokół badania (szczególnie formularz świadomej zgody) i zapewnia, że zgadza się z przepisami dotyczącymi bioetyki. Najwyższym priorytetem jest bezpieczeństwo, aby je zapewnić uczestnikom badania klinicznego, konieczne jest wewnętrzne zatwierdzenie projektu przez firmę, pozytywna opinia Komisji Bioetycznej oraz zgoda właściwego krajowego organu nadzorującego. Przepisy dotyczące badań Fazy I zostały zaostrzone po tym, jak w 2006 r. u ochotników miały miejsce przypadki ciężkich zdarzeń niepożądanych po zastosowaniu leku immunomodulacyjnego do leczenia przewlekłej białaczki limfatycznej b-komórkowej i reumatoidalnego zapalenia stawów.
Ponieważ bezpieczeństwo jest najważniejsze, podawanie leku w badaniu zaczyna się od bardzo niskiej dawki:
- każdy ochotnik otrzymuje jedną dawkę leku.
- Jeśli podanie pierwszej dawki okaże się bezpieczne, można kontynuować badanie z nieco wyższymi dawkami.
- Dawka jest zwiększana (dawka rosnąca) aż do osiągnięcia maksymalnej dozwolonej w danym badaniu.
Jest to opisane w Protokole badania.
Wyniki badania mogą następnie zostać poddane analizie, a środki bezpieczeństwa ocenie. Obejmuje to:
- farmakokinetykę — jak organizm przetwarza lek. Można zmierzyć stężenia leku we krwi, aby ocenić Absorpcję (wchłanianie), Dystrybucję, Metabolizm i Eliminację (wydalanie) (ADME)
- farmakodynamikę — wpływ leku na organizm („działanie”). Na przykład badanie może mierzyć działanie leku na pewne komórki krwi.
Ten rodzaj badania nosi nazwę badania metodą jednorazowej dawki rosnącej (Single Ascending Dose, SAD). Po nim zwykle następuje badanie metodą wielorazowej dawki rosnącej (Multiple Ascending Dose, MAD), które, jak sugeruje nazwa, wymaga podania wielu dawek każdemu ochotnikowi.
Oprócz badań SAD i MAD trzeba także przeprowadzić inne badania Fazy I. Na przykład:
- aby sprawdzić działanie pokarmów;
- aby sprawdzić działanie innych leków podawanych jednocześnie;
- aby sprawdzić wpływ innych chorób, które mogą powodować, że potrzebna jest inna dawka leku (np. pacjenci z chorobami nerek).
Piśmiennictwo
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford, UK: Wiley-Blackwell.
Załączniki
- Arkusz informacyjny: Badania typu „Proof of mechanism” („dowód mechanizmu działania”)
Size: 100,164 bytes, Format: .docx
Ten arkusz informacyjny dotyczy badań klinicznych Fazy I lub badań typu „Proof of mechanism”, pierwszych badań, podczas których cząsteczka „kandydująca” jest testowana z udziałem ludzi.
- Prezentacja: Podstawowe zasady dotyczące odkrywania i rozwoju leków
Size: 920,260 bytes, Format: .pptx
Podstawowe zasady dotyczące odkrywania i rozwoju leków. Przeprowadzenie wszystkich badań i prac koniecznych do wprowadzenia nowego leku na rynek zajmuje ponad 12 lat i kosztuje ponad 1 mld euro. W tej prezentacji szczegółowo przedstawiono proces od odkrycia nowego leku do wprowadzenia go na rynek oraz późniejsze działania.
A2-1.02.5-v1.1