Last update: 3 sierpnia 2015
Wprowadzenie
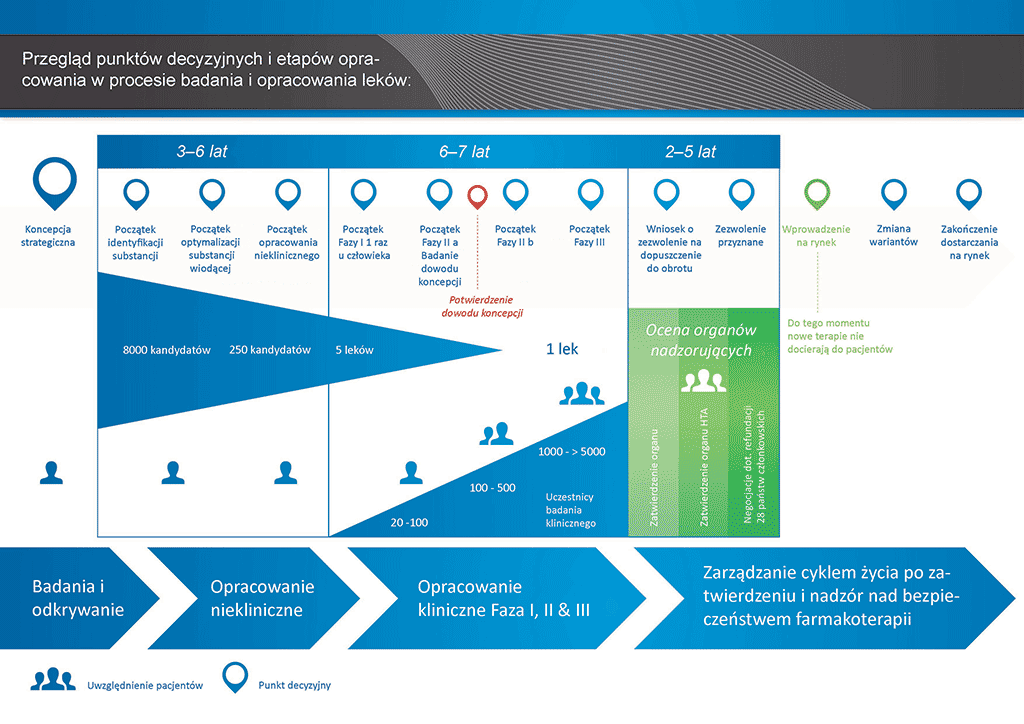
Przeprowadzenie wszystkich badań i prac koniecznych do wprowadzenia nowego leku na rynek zajmuje ponad 12 lat i kosztuje średnio ponad 1 mld euro.
Odkrywanie nowych leków jest przedsięwzięciem o wysokim ryzyku. Większość (około 98%) opracowywanych substancji nie trafia na rynek w postaci nowych leków. Zwykle powodem tego jest fakt, że korzyści i ryzyko (negatywne działania niepożądane) ujawniane w procesie rozwoju nie wytrzymują porównania z lekami już dostępnymi dla pacjentów.
Opracowanie nowego leku można podzielić na 10 etapów. Ten artykuł dotyczy etapu 8: badania potwierdzające.
- Proces opracowania leku zajmuje ponad dziesięć lat planowania i badań pozwalających przejść od cząsteczki do dostępnego na rynku leczenia.
Etap 8: Przygotowanie do rejestracji: Badania kliniczne Fazy III — badania potwierdzające
Badania kliniczne Fazy III (określane także jako badania potwierdzające) są największą, najbardziej skomplikowaną i kosztowną częścią rozwoju leku. Ich celem jest potwierdzenie skuteczności i bezpieczeństwa stosowania cząsteczki „kandydującej” w dużej populacji pacjentów.
Decyzja o przejściu do Fazy III jest podejmowana wyłącznie wówczas, jeśli uzasadniają ją wszystkie informacje z wcześniejszych badań, jak i jednostek produkcyjnych i biznesowych. Niezwykle istotny jest także projekt takiego badania. Dlatego przed rozpoczęciem badań klinicznych Fazy III są przeprowadzane liczne rozmowy z ekspertami zewnętrznymi, organami nadzorującymi, grupami pacjentów i innymi. Dzięki temu można mieć pewność, że zadano odpowiednie pytania i zebrano odpowiednie informacje. Niezwykle ważna jest także liczba pacjentów biorących udział w badaniu, ponieważ pozwala prawidłowo zinterpretować wyniki i spełnić wymagania organów nadzorujących.
Ważne decyzje są podejmowane na podstawie wszystkich informacji z wcześniejszych etapów, a w tym:
- ostateczna postać farmaceutyczna leku (sposób połączenia leku z innymi substancjami chemicznymi);
- testowana dawka;
- rekrutacja pacjentów (kryteria włączenia);
- pacjenci niemogący brać udziału w badaniu (kryteria wykluczenia);
- wymagana liczba pacjentów;
- projekt badania;
- długość badania;
- sposób mierzenia skuteczności i bezpieczeństwa;
- wykorzystywane testy statystyczne.
Badania na tym etapie mogą objąć tysiące pacjentów. Zależy to jednak od zamierzonego wykorzystania leku w terapii (wskazanie). Badania Fazy III można przeprowadzać na przykład w mniejszych populacjach, jeśli wskazaniem do stosowania leku jest choroba występująca niezbyt często.
Badania kliniczne Fazy III mogą obejmować tysiące pacjentów, odbywają się w wielu krajach, a ich skuteczne przeprowadzenie może wymagać wielkiego doświadczenia. Dlatego też są kosztowne i pochłaniają wiele czasu. Jest to jednak jedyny sposób, aby uzyskać jasny obraz relacji pomiędzy skutecznością leku (czy działa) i bezpieczeństwa jego stosowania (czy jest dobrze tolerowany), co jest ogromnie istotne.
Badania kliniczne Fazy III są największą, najbardziej skomplikowaną i kosztowną częścią procesu rozwoju leku. Ponad 50% leków nie przechodzi tego etapu. Całościowy współczynnik niepowodzenia projektów, które rozpoczynają się od fazy odkrywania przekracza 97%. Przychody z kilku leków wprowadzonych na rynek pokrywają koszty wszystkich projektów, zarówno zakończonych sukcesem, jak i niepowodzeniem.
Piśmiennictwo
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Załączniki
- Arkusz informacyjny: badania potwierdzające
Size: 97,748 bytes, Format: .docx
Ten arkusz informacyjny dotyczy badań klinicznych Fazy III, które są najdłuższymi, najbardziej złożonymi i najkosztowniejszymi badaniami w procesie opracowania leków.
- Prezentacja: Podstawowe zasady dotyczące odkrywania i rozwoju leków
Size: 920,260 bytes, Format: .pptx
Podstawowe zasady dotyczące odkrywania i rozwoju leków. Przeprowadzenie wszystkich badań i prac koniecznych do wprowadzenia nowego leku na rynek zajmuje ponad 12 lat i kosztuje ponad 1 mld euro. W tej prezentacji szczegółowo przedstawiono proces od odkrycia nowego leku do wprowadzenia go na rynek oraz późniejsze działania.
A2-1.02.7-v1.1