Last update: 3 Agosto 2015
Introduzione
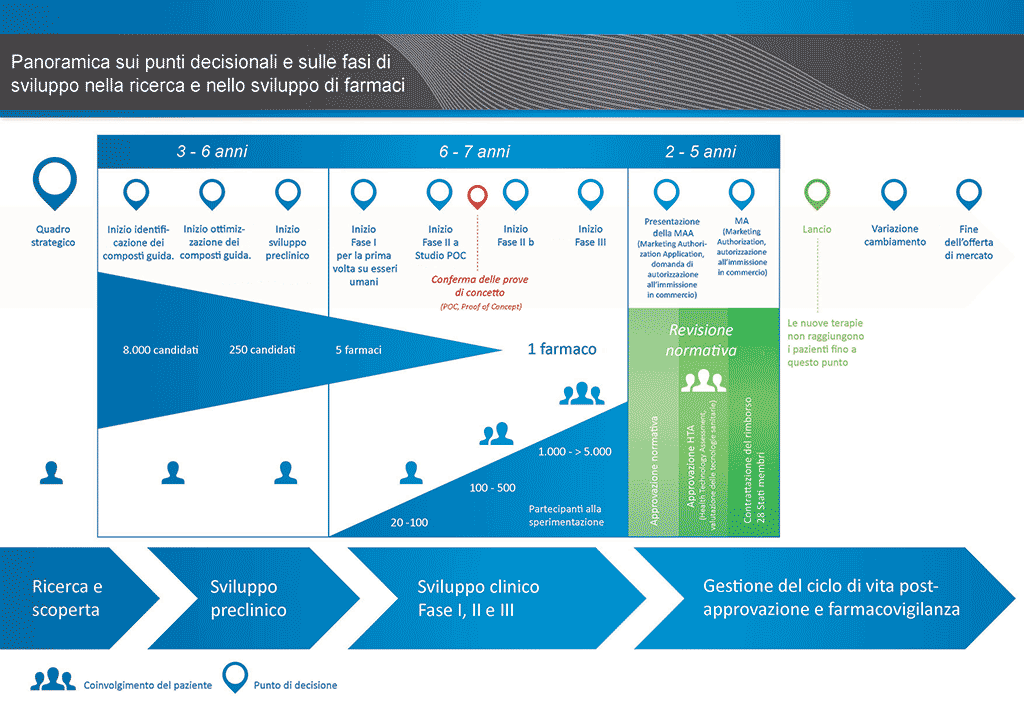
Sono necessari più di 12 anni e in media più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti.
Lo sviluppo di farmaci è un’impresa ad alto rischio. La maggioranza (circa il 98%) delle sostanze sviluppate non riesce ad arrivare sul mercato come nuovo medicinale. Ciò accade soprattutto perché osservando i benefici e i rischi (effetti collaterali negativi) riscontrati durante lo sviluppo, non sono comparabili positivamente rispetto ai farmaci già disponibili per i pazienti.
Lo sviluppo di un nuovo farmaco può essere suddiviso in 10 fasi diverse. Il seguente articolo si occupa della Fase 8: studi di conferma.
- Occorrono oltre 10 anni di attenta pianificazione e ricerca perché un farmaco passi da molecola a trattamento disponibile sul mercato.
Fase 8: Sviluppo per il lancio: studi clinici di Fase III – studi di conferma
Gli studi di Fase III (chiamati anche studi di conferma) sono la parte più estesa, più complicata e costosa dello sviluppo di un farmaco. Il loro scopo è confermare l'efficacia e la sicurezza del candidato composto in un'ampia popolazione di pazienti.
La decisione di passare agli studi di Fase III viene presa solo se essa è supportata da tutte le informazioni provenienti dagli studi precedenti, così come dall'unità produttiva e da quella aziendale. Il disegno di tali studi è anch'esso d'importanza decisiva. Pertanto, prima che gli studi di Fase III abbiano inizio, si tiene un gran numero di discussioni con esperti esterni, autorità di regolamentazione, gruppi di pazienti e altri. In questo modo è garantito che vengano fatte le domande giuste e vengano raccolte le informazioni corrette. Affinché i risultati possano essere interpretati in modo appropriato e soddisfino i requisiti delle autorità di regolamentazione, anche il numero dei pazienti nello studio è molto importante.
Tutte le informazioni raccolte a partire dai primi stadi sono utilizzate per prendere decisioni importanti, tra cui:
- la formulazione finale del medicinale (il modo in cui il farmaco attivo si combina con altre sostanze chimiche)
- la dose che deve essere studiata
- quali pazienti possono essere reclutati (criteri d'inclusione)
- quali pazienti non possono essere inclusi (criteri d'esclusione)
- quanti pazienti sono necessari
- il disegno dello studio
- la lunghezza dello studio
- in che modo saranno misurate l'efficacia e la sicurezza
- i test statistici che saranno utilizzati.
A questo stadio le sperimentazioni possono coinvolgere migliaia di pazienti. In ogni modo, ciò dipende da cosa si prevede che il farmaco debba trattare (l'"indicazione"). Ad esempio, studi di Fase III possono essere svolti in popolazioni di piccole dimensioni se l'indicazione è un disturbo non comune.
Gli studi di Fase III possono coinvolgere migliaia di pazienti, sono svolti in molti paesi e per essere condotti efficacemente necessitano di un'entità molto ingente di competenze. Pertanto, sono molto costosi e richiedono molto tempo. Tuttavia, questo è l'unico modo per produrre un'immagine chiara del rapporto tra l'efficacia del farmaco (se funziona) e la sua sicurezza (se è ben tollerato), il che è molto importante.
Gli studi di Fase III costituiscono la parte più estesa, più complicata e costosa del processo di sviluppo di un farmaco. Più del 50% dei farmaci fallisce in questa fase. Globalmente, il tasso d'insuccesso dei progetti a partire dallo stadio della scoperta è superiore al 97%. I ricavi provenienti dai pochi farmaci che arrivano sul mercato coprono i costi di tutti i progetti, sia quelli falliti, sia quelli riusciti.
Riferimenti bibliografici
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Allegati
- Scheda informativa: studi di conferma
Size: 97,708 bytes, Format: .docx
Questa scheda informativa si occupa degli studi clinici di Fase III, gli studi più estesi, più complicati e costosi nel processo di sviluppo dei farmaci.
- Presentazione: i principi di base relativi alla scoperta e allo sviluppo di farmaci
Size: 877,906 bytes, Format: .pptx
I principi di base relativi alla scoperta e allo sviluppo di farmaci. Sono necessari più di 12 anni e più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti. Questa presentazione spiega in dettaglio il percorso a partire dalla scoperta fino all’immissione sul mercato di un nuovo farmaco e oltre.
A2-1.02.7-v1.1