Last update: 3 августа 2015
Введение
В среднем на все исследования и разработки, необходимые для того, чтобы новый лекарственный препарат был доступен для пациентов, уходит более 12 лет и более 1 миллиарда евро.
Разработка лекарственных препаратов — это рисковый бизнес. Большинство разрабатываемых соединений (около 98 %) так и не выходят на рынок. Так происходит потому, что при оценке преимуществ и рисков (негативных побочных эффектов), обнаруживаемых в ходе разработки, сложно сравнивать их с уже имеющимися на рынке препаратами.
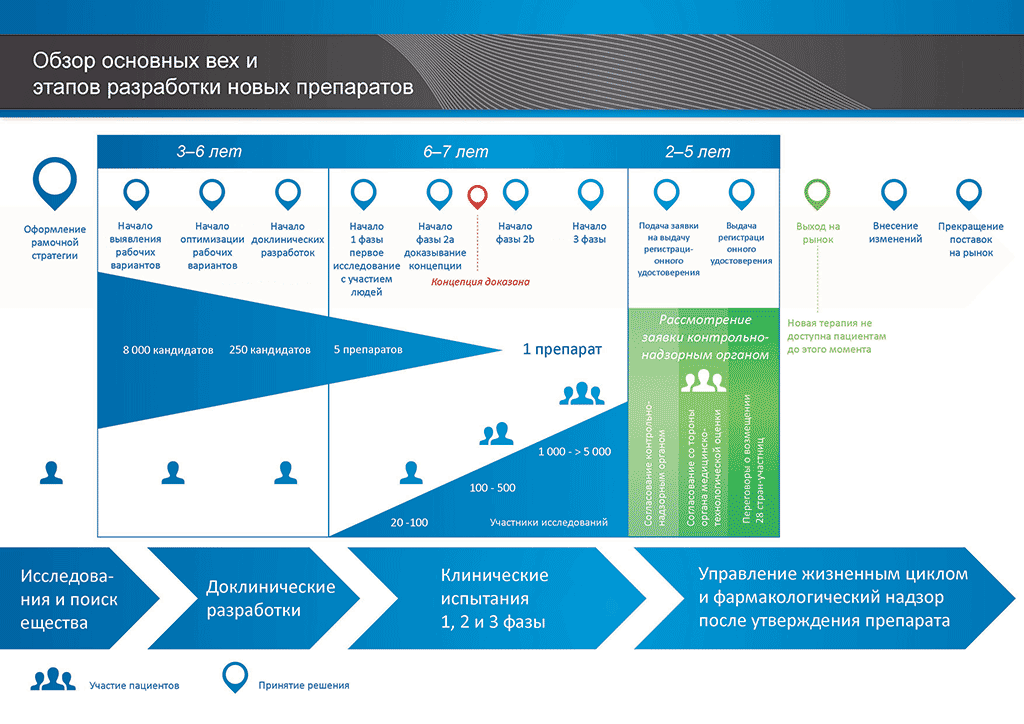
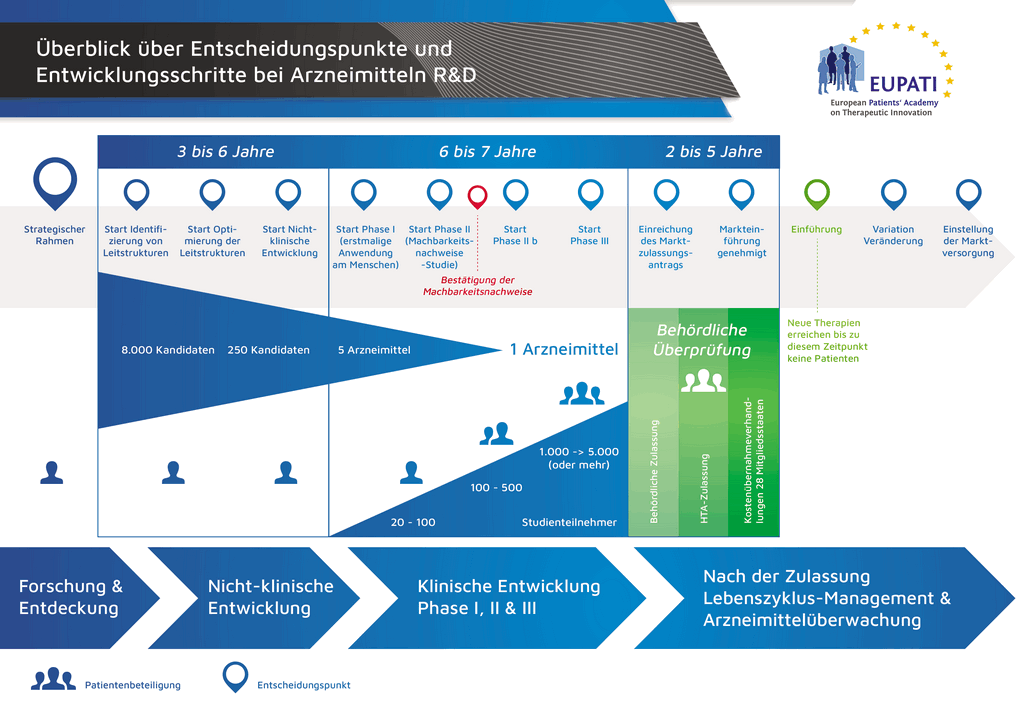
Процесс разработки нового лекарственного препарата можно представить в 10 шагах. Следующая статья описывает 8-й шаг. Подтверждающие исследования.
- С момента создания молекулы до момента начала продажи медицинского препарата проходит больше 10 лет, необходимых для тщательнейшего планирования и исследований.
- Es benötigt mehr als 10 Jahre sorgfältiger Planung und Forschung, bis ein Arzneimittel sich vom Molekül zur marktfähigen Behandlung entwickelt hat.
Шаг 8: Разработка с целью запуска на рынок Клинические исследования 3 фазы – Подтверждающие исследования
Исследования 3 фазы (также именуемые «подтверждающими исследованиями») — самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
Решение о переходе к исследованиям 3 фазы принимается, только если это обосновано данными предыдущих исследований и информацией, поступающей от предприятий-производителей и бизнес-подразделений. Также очень важно то, как будут устроены эти исследования. Поэтому до начала исследований 3 фазы проводится много дискуссий с участием внешних экспертов, контрольно-надзорных органов, групп защиты прав пациентов и прочих лиц. Это позволяет поднять нужные вопросы и получить нужные данные. Также имеет важное значение количество пациентов, участвующих в исследовании, так как это влияет на то, возможно ли будет надлежащим образом проанализировать результаты и выполнить требования контрольно-надзорных органов.
Все данные, собранные на предыдущих этапах, используются для принятия важных решений, включая
- окончательный состав препарата (с какими другими химическими веществами будет смешиваться активное вещество);
- испытываемую дозу;
- какие пациенты могут быть набраны в исследование (критерии включения);
- какие пациенты не могут быть набраны в исследование (критерии исключения);
- сколько пациентов должно быть набрано;
- дизайн исследования;
- продолжительность исследования;
- как будет измеряться эффективность и безопасность;
- какие статистические анализы будут применяться.
На этом этапе в исследованиях могут принимать участие тысячи пациентов. Однако это зависит от заболевания, для лечения которого предназначен препарат («показания к применению»). Например, исследования 3 фазы могут проводиться для менее больших выборок в случаях, когда показания к применению представляют собой редкие случаи.
В исследованиях 3 фазы могут участвовать тысячи пациентов из многих стран мира, и для эффективного проведения таких исследований необходим громадный опыт и навыки. Поэтому они очень дорогостоящие и занимают много времени. Однако это единственный способ получить достоверное представление о том, как связаны эффективность препарата (т.е. действует ли он) и его безопасность (хорошо ли переносится), что очень важно.
Исследования 3 фазы — самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Более 50 % лекарственных препаратов не преодолевают этот этап. В целом, если говорить о всех проектах, неудачными оказываются более 97 % проектов. Доходы, которые будут получены от тех немногих препаратов, которые в итоге выйдут на рынок, должны покрыть издержки на все проекты, как успешные, так и неуспешные.
Справочная литература
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Приложения
- Информационный бюллетень: Подтверждающие исследования
Size: 98,277 bytes, Format: .docx
В этом информационном бюллетене описываются клинические исследования 3 фазы, которые представляют собой самую крупномасштабную, сложную и дорогостоящую часть процесса разработки препарата.
A2-1.02.7-v1.1