Last update: 3 sierpnia 2015
Wprowadzenie
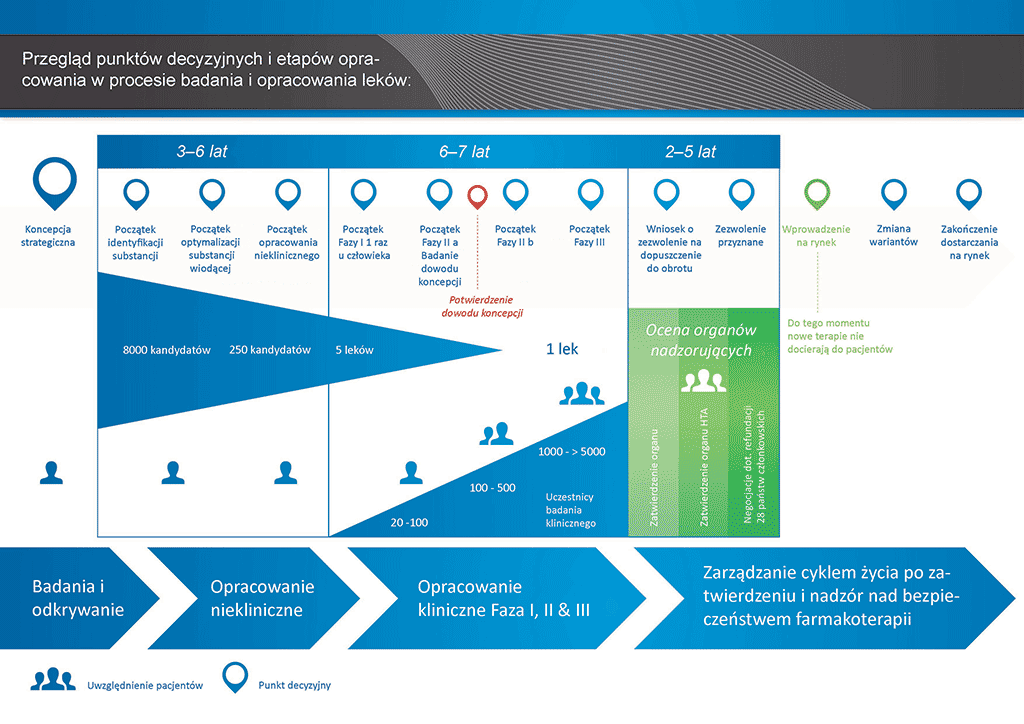
Przeprowadzenie wszystkich badań i prac koniecznych do wprowadzenia nowego leku na rynek zajmuje ponad 12 lat i kosztuje średnio ponad 1 mld euro.
Odkrywanie nowych leków jest przedsięwzięciem o wysokim ryzyku. Większość (około 98%) opracowywanych substancji nie trafia na rynek w postaci nowych leków. Zwykle powodem tego jest fakt, że korzyści i ryzyko (negatywne działania niepożądane) ujawniane w procesie rozwoju nie wytrzymują porównania z lekami już dostępnymi dla pacjentów.
Opracowanie nowego leku można podzielić na 10 etapów. Ten artykuł dotyczy etapu 10: Wprowadzenie do obrotu i ocena bezpieczeństwa po wprowadzeniu produktu na rynek oraz zarządzanie cyklem życia produktu.
- Proces opracowania leku zajmuje ponad dziesięć lat planowania i badań pozwalających przejść od cząsteczki do dostępnego na rynku leczenia.
Wprowadzenie do obrotu i ocena bezpieczeństwa po wprowadzeniu produktu na rynek
Proces wprowadzania na rynek obejmuje informowanie o nowym leku lekarzy i innych pracowników ochrony zdrowia, aby mieli świadomość jego działania i mogli go przepisywać, jeśli w ich przekonaniu mógłby okazać się korzystny dla pacjentów.
Nie jest to jednak koniec procesu opracowania nowego leku. Nadal trzeba zbierać i analizować informacje dotyczące bezpieczeństwa leku stosowanego w „rzeczywistym życiu” (określa się to jako nadzór nad bezpieczeństwem farmakoterapii). Jest to potrzebne, ponieważ:
- W badaniach klinicznych (zaprojektowanych tak, aby dawały jasne odpowiedzi) idealną sytuacją jest, kiedy pacjent cierpi wyłącznie na badaną chorobę i nie przyjmuje innych leków.
- W rzeczywistym życiu wielu pacjentów przyjmuje nowy lek. Mogą cierpieć na różne inne choroby i przyjmować wiele innych leków.
Zarówno dane z badań klinicznych, jak i z rzeczywistego stosowania są konieczne do uzyskania pełnej wiedzy na temat faktycznej relacji korzyści do ryzyka dotyczącej stosowania leku.
Zarządzanie cyklem życia produktu
Po wprowadzeniu nowego leku na rynek bada się nadal:
- Inne możliwe zastosowania (wskazania do stosowania) leku. Jeśli na przykład pierwotne zastosowanie dotyczyło pacjentów z astmą, nowe wskazania mogą obejmować pacjentów z różnymi chorobami płuc, np. przewlekłą obturacyjną chorobą płuc.
- Lepsze sposoby sporządzania i używania leku (nowe postacie farmaceutyczne). Może na przykład powstać specjalna postać farmaceutyczna dla dzieci.
Te wszystkie działania określa się jako „zarządzanie cyklem życia”.
Inne zmiany w cyklu życia leku
Lek wprowadzany na rynek po raz pierwszy jest chroniony patentem. To oznacza, że inne firmy nie mogą wprowadzić na rynek podobnego leku. Po zakończeniu okresu ochrony patentowej lub ochrony danych inne firmy będą produkować i wprowadzać na rynek taki sam produkt. Taki produkt określa się jako „generyczny”.
Nowe leki są zwykle dopuszczane do wydawania wyłącznie na receptę (Prescription-Only Medicines, POM). To znaczy, że w ciągu pierwszych kilku lat lekarze mogą nadzorować ich stosowanie. Jeśli jest to możliwe i bezpieczne, w późniejszym okresie można zezwolić na sprzedaż leku bez recepty, jak tzw. lek OTC (Over-The-Counter). Wymaga to zmian statusu prawnego leku i nowej licencji. Pacjenci mogą kupować leki OTC bezpośrednio w aptece lub supermarkecie (zależnie od kraju).
Piśmiennictwo
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Załączniki
- Arkusz informacyjny: Ocena bezpieczeństwa oraz zarządzanie cyklem życia produktu
Size: 98,133 bytes, Format: .docx
Ocena bezpieczeństwa oraz zarządzanie cyklem życia produktu. Ten arkusz informacyjny dotyczy działań mających miejsce po pozwoleniu przez organy nadzorujące na wprowadzenie leku do obrotu. Działania te obejmują wprowadzenie do obrotu, ocenę bezpieczeństwa i inne czynności związane z zarządzaniem cyklem życia produktu.
- Prezentacja: Podstawowe zasady dotyczące odkrywania i rozwoju leków
Size: 920,260 bytes, Format: .pptx
Podstawowe zasady dotyczące odkrywania i rozwoju leków. Przeprowadzenie wszystkich badań i prac koniecznych do wprowadzenia nowego leku na rynek zajmuje ponad 12 lat i kosztuje ponad 1 mld euro. W tej prezentacji szczegółowo przedstawiono proces od odkrycia nowego leku do wprowadzenia go na rynek oraz późniejsze działania.
A2-1.02.9-v1.1