Last update: 3 August 2015
Einleitung
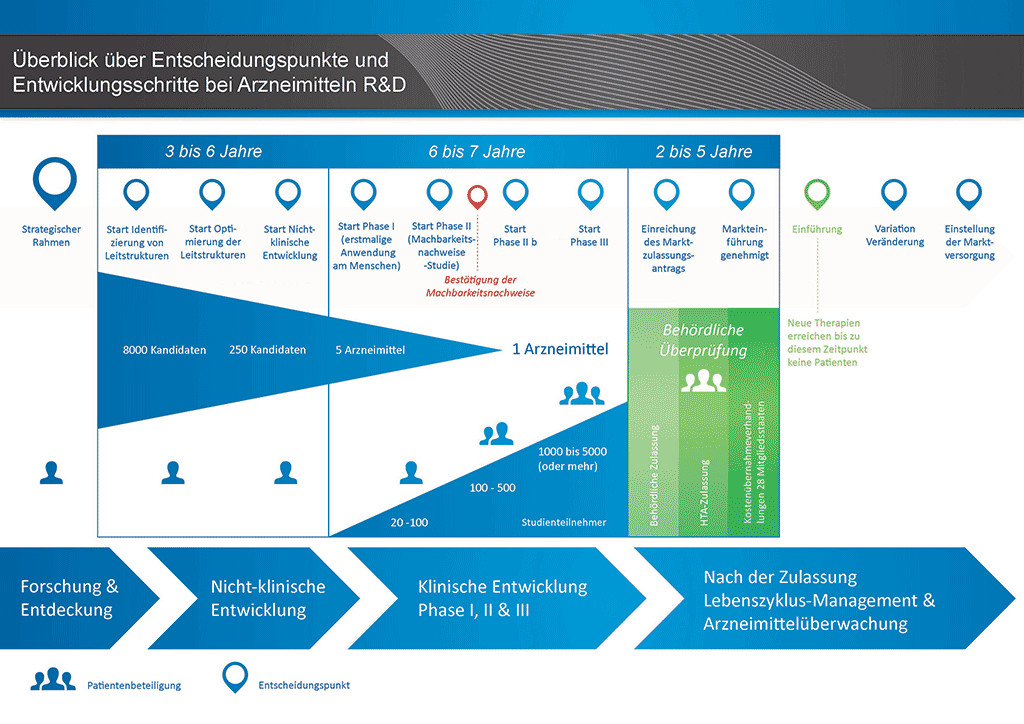
Es dauert über 12 Jahre und kostet durchschnittlich mehr als eine Milliarde Euro, all die Forschungs- und Entwicklungsarbeiten durchzuführen, die erforderlich sind, bis ein neues Arzneimittel für die Behandlung von Patienten zur Verfügung steht.
Arzneimittelentwicklung ist ein risikoreiches Geschäft. Der größte Teil (ca. 98 %) neu entwickelter Wirkstoffe schafft es nicht, als neues Arzneimittel auf den Markt zu gelangen. Das liegt daran, dass das Verhältnis zwischen dem Nutzen und den im Verlauf der Entwicklung festgestellten Risiken (schädliche Nebenwirkungen) dem Vergleich mit anderen, bereits für die Behandlung von Patienten verfügbaren Arzneimitteln meist nicht standhält.
Die Entwicklung eines neuen Arzneimittels kann in zehn unterschiedliche Schritte unterteilt werden. Der folgende Artikel behandelt Schritt 10: Markteinführung und Sicherheitsüberwachung nach Markteinführung und Lebenszyklus-Management.
- Es benötigt mehr als 10 Jahre sorgfältiger Planung und Forschung, bis ein Arzneimittel sich vom Molekül zur marktfähigen Behandlung entwickelt hat.
Markteinführung und Sicherheitsüberwachung nach Markteinführung
Im Rahmen der Markteinführung werden Ärzte und andere im Gesundheitswesen Tätige über das neue Arzneimittel informiert, damit diese die Wirkung des neuen Arzneimittels kennenlernen und es in Fällen, in denen Patienten ihrer Meinung nach davon profitieren könnten, verordnen können.
Der Entwicklungsprozess hört an dieser Stelle jedoch nicht auf. Nach wie vor besteht die Notwendigkeit, Informationen zur Sicherheit des Arzneimittels in der „realen Welt“ zu sammeln und zu analysieren (so genannte Pharmakovigilanz). Hierfür gibt es u. a. die folgenden Gründe:
- Patienten in klinischen Studien (die konzipiert wurden, klare Antworten zu geben) leiden idealerweise nur an der untersuchten Krankheit und nehmen keine anderen Arzneimittel ein.
- In der „realen Welt“ nimmt eine große Zahl von Patienten das neue Arzneimittel ein. Diese könnten verschiedene andere Krankheiten haben und eine Reihe anderer Arzneimittel einnehmen.
Daten aus klinischen Studien wie aus der „realen Welt“ sind nötig, um das tatsächliche Nutzen-Risiko-Verhältnis des Arzneimittels voll und ganz verstehen zu können.
Lebenszyklus-Management
Nach Markteinführung des Arzneimittels stellen sich dem fortgesetzten Entwicklungsprozess verschiedene Forschungsziele:
- Andere denkbare Einsatzmöglichkeiten (Indikationen) für das Arzneimittel. War der ursprüngliche Einsatz beispielsweise die Behandlung von Patienten mit Asthma, könnte eine neue Indikation bei Patienten mit verschiedenen Arten von Lungenkrankheiten (z. B. chronisch obstruktive Lungenkrankheit) gegeben sein.
- Verbesserte Wege der Arzneimittelherstellung und -nutzung (neue Rezepturen), z. B. eine spezielle Rezeptur für Kinder.
Alle diese Aktivitäten werden unter dem Begriff „Lebenszyklus-Management“ zusammengefasst.
Weitere Veränderungen im Lebenszyklus eines Arzneimittels
Wenn ein Arzneimittel neu vermarktet wird, ist es durch ein „Patent“ geschützt. Das bedeutet, dass andere Unternehmen kein ähnliches Arzneimittel vermarkten dürfen. Am Ende der Patent- oder Datenschutzperiode werden andere Unternehmen das gleiche Produkt herstellen und vermarkten. Ein solches, von einem anderen als dem ursprünglichen Entwickler auf den Markt gebrachtes Produkt wird als „Generikum“ bezeichnet.
Neue Arzneimittel sind in der Regel zunächst verschreibungspflichtig. Auf diese Weise kann deren Anwendung in den ersten paar Jahren überwacht werden. Wo es angebracht und sicher ist, kann das Arzneimittel später rezeptfrei angeboten werden. Dies bringt eine Änderung des zulassungsrechtlichen Status des Arzneimittels mit sich und erfordert eine neue Lizenz. Patienten können rezeptfreie Arzneimittel ohne ärztliche Verordnung in der Apotheke kaufen.
Quellenangaben
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Anlagen
- Datenblatt: Sicherheitsüberwachung und Lebenszyklus-Management
Size: 98,161 bytes, Format: .docx
Sicherheitsüberwachung und Lebenszyklus-Management. Dieses Datenblatt behandelt die Aktivitäten nach Zulassung eines Arzneimittels durch die Zulassungsbehörden. Zu diesen zählen Markteinführung, Sicherheitsüberwachung und andere Aktivitäten des Lebenszyklus-Managements.
- Präsentation: Die grundlegenden Prinzipien der Arzneimittelentdeckung und -entwicklung
Size: 945,895 bytes, Format: .pptx
Die grundlegenden Prinzipien der Arzneimittelentdeckung und -entwicklung. Es dauert über 12 Jahre und kostet mehr als eine Milliarde Euro, all die Forschungs- und Entwicklungsarbeiten durchzuführen, die erforderlich sind, bis ein neues Arzneimittel für die Behandlung von Patienten zur Verfügung steht. Diese Präsentation stellt die Details des Prozesses von der Entdeckung bis zur Markteinführung eines neuen Arzneimittels und darüber hinaus vor.
A2-1.02.9-v1.1