Last update: 3 августа 2015
Введение
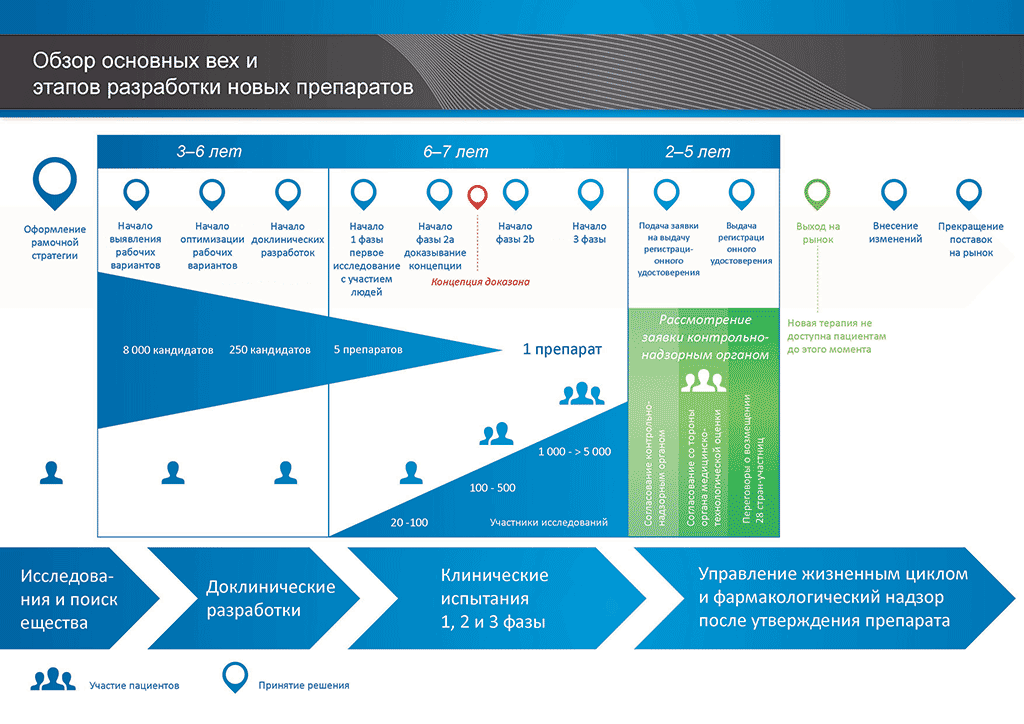
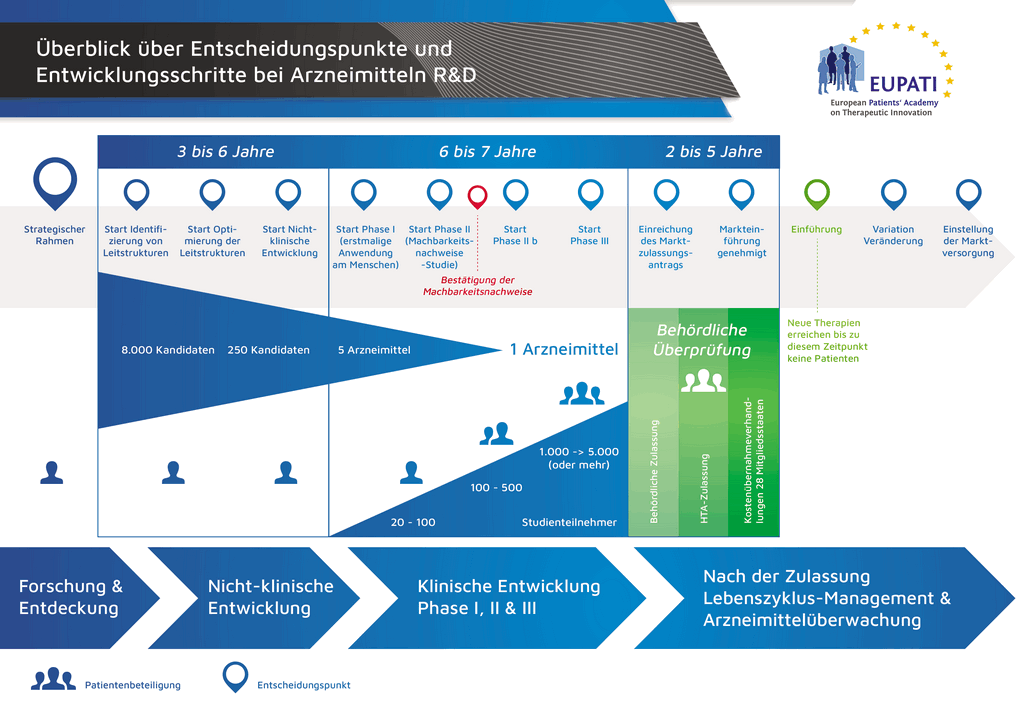
В среднем на все исследования и разработки, необходимые для того, чтобы новый лекарственный препарат был доступен для пациентов, уходит более 12 лет и более 1 миллиарда евро.
Разработка лекарственных препаратов — это рисковый бизнес. Большинство разрабатываемых соединений (около 98 %) так и не выходят на рынок. Так происходит потому, что при оценке преимуществ и рисков (негативных побочных эффектов), обнаруживаемых в ходе разработки, сложно сравнивать их с уже имеющимися на рынке препаратами.
Процесс разработки нового лекарственного препарата можно представить в 10 шагах. В следующей статье описывается 10-й шаг. Маркетинговые мероприятия и постмаркетинговое наблюдение за безопасностью и управление жизненным циклом.
- С момента создания молекулы до момента начала продажи медицинского препарата проходит больше 10 лет, необходимых для тщательнейшего планирования и исследований.
- Es benötigt mehr als 10 Jahre sorgfältiger Planung und Forschung, bis ein Arzneimittel sich vom Molekül zur marktfähigen Behandlung entwickelt hat.
Маркетинговые мероприятия и постмаркетинговое наблюдение за безопасностью
Маркетинговый процесс подразумевает распространение информации о новом препарате среди врачей и прочих специалистов системы здравоохранения с тем, чтобы они были в курсе нового препарата и могли назначать его для своих пациентов, если сочтут это необходимым.
Однако процесс разработки на этом не заканчивается. Необходимость собирать и анализировать данные о безопасности препарата в ходе его использования в реальной жизни («фармакологический надзор») остается актуальной. Это продиктовано следующим:
- В клинических исследованиях (которые устроены так, чтобы давать четкие ответы) пациенты в идеальном случае имеют только изучаемое заболевание и не принимают другие препараты.
- В реальной жизни новый препарат принимает большое количество пациентов. У них могут быть сопутствующие заболевания, и они могут принимать сопутствующие препараты.
Для того, чтобы понять действительное соотношение преимуществ и рисков, необходимы данные о применении препарата как в клинических исследованиях, так и в реальной жизни.
Управление жизненным циклом
После выхода препарата на рынок процесс разработки не прекращается, поскольку специалисты продолжают выяснять
- прочие возможные способы применения (показания к применению) препарата. Например, изначально препарат может быть показан при астме, но впоследствии он может оказаться полезным для пациентов с прочими заболеваниями дыхательной системы, например, при хронической обструктивной болезни легких.
- усовершенствованные способы изготовления и использования препарата (новые лекарственные формы). Например, особая лекарственная форма для детей.
Эти мероприятия составляют «управление жизненным циклом».
Прочие изменения в жизненном цикле препарата
Когда препарат впервые выходит на рынок, он защищен патентом. Это означает, что другие компании не могут продавать подобный препарат. После того, как патент или срок охраны авторских прав истечет, другие компании смогут производить и продавать этот препарат. Тогда препарат становится «дженериком».
Новые препараты обычно выходят на рынок в качестве отпускаемых только по рецепту врача. Это позволяет специалистам здравоохранения отслеживать использование препарата в первые несколько лет. Если это уместно и безопасно, впоследствии препарат может отпускаться без рецепта врача. В этом случае на препарат необходима новая лицензия от контрольно-надзорных органов. Когда препарат отпускается без рецепта, пациент может приобрести его сам в аптеке или супермаркете (в зависимости от страны).
Справочная литература
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Приложения
- Информационный бюллетень: Наблюдение за безопасностью и управление жизненным циклом
Size: 98,577 bytes, Format: .docx
Наблюдение за безопасностью и управление жизненным циклом. В этом информационном бюллетене описывается процесс, который начинается сразу после получения в контрольно-надзорных органах регистрационного свидетельства на лекарственный препарат. Этот процесс включается маркетинговые мероприятия, наблюдение за безопасностью и другие виды работ, из которых состоит управление жизненным циклом.
A2-1.02.9-v1.1