Last update: 3 augustus 2015
Inleiding
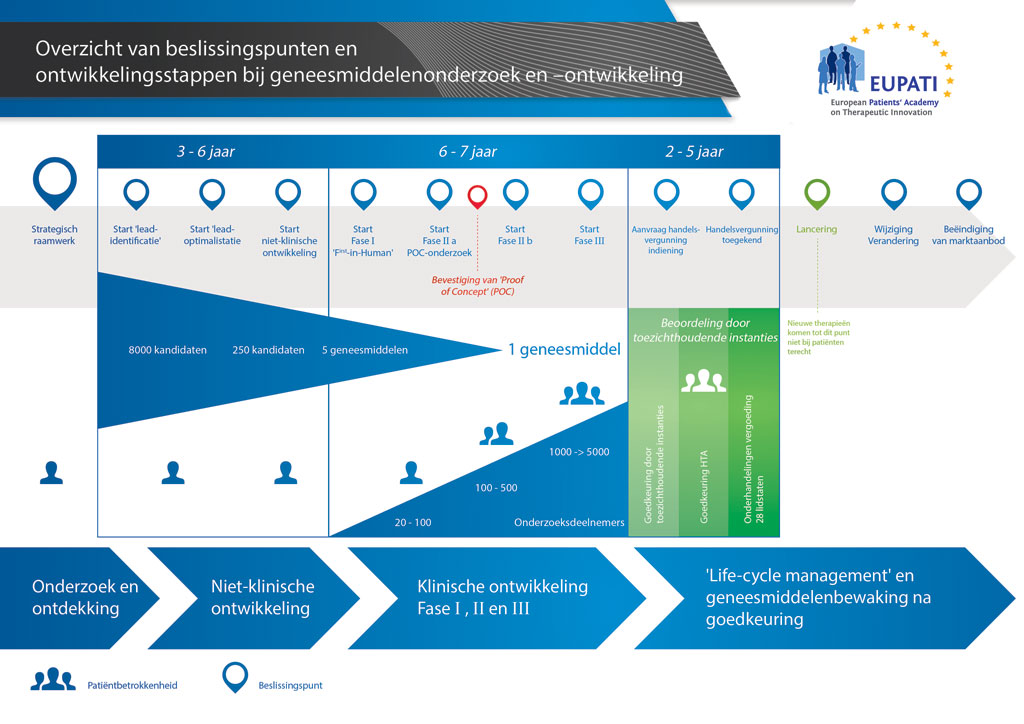
Gemiddeld duurt het ruim 12 jaar en kost het meer dan 1 miljard euro om al het benodigde onderzoeks- en ontwikkelingswerk te doen voordat een nieuw geneesmiddel beschikbaar komt om door patiënten te worden gebruikt.
Geneesmiddelenontwikkeling is een risicovolle onderneming. De meeste stoffen (ongeveer 98%) die worden ontwikkeld, halen de markt niet als nieuw geneesmiddel. Dit komt voornamelijk doordat de voordelen en risico’s (negatieve bijwerkingen) die tijdens de ontwikkeling worden geconstateerd, zich slecht verhouden tot geneesmiddelen die al verkrijgbaar zijn voor patiënten.
De ontwikkeling van een nieuw geneesmiddel kan worden onderverdeeld in 10 verschillende stappen. Het volgende artikel gaat over Stap 10: Veiligheidsbewaking voor en na het in de handel brengen en beheer gedurende de gehele levenscyclus.
- Er kunnen meer dan 10 jaar aan nauwkeurig plannen en onderzoek nodig zijn om een geneesmiddel te ontwikkelen van een molecuul tot een verkoopbare behandeling.
Veiligheidsbewaking voor en na het in de handel brengen
Het in de handel brengen van een geneesmiddel is een proces waarbij informatie over het nieuwe geneesmiddel wordt gedeeld met artsen en andere zorgverleners zodat zij de effecten van het geneesmiddel kennen, en het kunnen voorschrijven wanneer ze denken dat patiënten er baat bij kunnen hebben.
Maar het ontwikkelingsproces is daarmee nog niet afgelopen. Het is nog steeds nodig om informatie te verzamelen en analyseren over de veiligheid van het geneesmiddel wanneer het in het ‘echte leven’ wordt gebruikt (zogeheten geneesmiddelenbewaking). De reden hiervoor:
- Patiënten in klinische onderzoeken (die zijn ontworpen om heldere antwoorden te geven) hebben idealiter alleen de bestudeerde ziekte en gebruiken geen andere geneesmiddelen.
- In het echte leven gebruiken grote aantallen patiënten het nieuwe geneesmiddel. Ze hebben misschien diverse andere ziekten en gebruiken uiteenlopende andere geneesmiddelen.
Er zijn gegevens uit zowel klinische onderzoeken als de realiteit nodig om een volledig begrip te krijgen van de werkelijke baten-risicoverhouding van het geneesmiddel.
‘Life-cycle management’
Nadat een geneesmiddel in de handel verschijnt, gaat het ontwikkelingsproces verder om de volgende zaken te onderzoeken:
- andere mogelijke vormen van gebruik (indicaties) voor het geneesmiddel. Bijvoorbeeld, als het aanvankelijke gebruik voor patiënten met astma was, zou een nieuwe indicatie voor patiënten met een ander type longziekte kunnen zijn, bijvoorbeeld een chronisch obstructieve longziekte.
- betere manieren om het geneesmiddel te maken en gebruiken (nieuwe formuleringen). Bijvoorbeeld, een speciale formulering voor kinderen.
Al deze activiteiten worden aangeduid als ‘life-cycle management’.
Andere veranderingen gedurende de levenscyclus van een geneesmiddel
Wanneer een geneesmiddel voor het eerst in de handel wordt gebracht, wordt het beschermd via een ‘octrooi’. Dit betekent dat andere bedrijven een vergelijkbaar geneesmiddel niet in de handel mogen brengen. Aan het einde van de octrooi- of gegevensbeschermingsperiode gaan andere bedrijven hetzelfde product vervaardigen en in de handel brengen. Als dit gebeurt, wordt het product ‘generiek’ genoemd.
Nieuwe geneesmiddelen krijgen meestal een vergunning als receptplichtig geneesmiddel. Dit wil zeggen dat zorgverleners in de eerste jaren kunnen toezien op het gebruik ervan. Waar van toepassing en veilig kan het geneesmiddel ook beschikbaar worden gemaakt als vrij verkrijgbaar geneesmiddel (over-the-counter, OTC). Dit behelst een verandering in de wettelijke status van het geneesmiddel en er is een nieuwe vergunning nodig. Patiënten kunnen het OTC-geneesmiddel rechtstreeks aanschaffen in een apotheek of supermarkt (afhankelijk van het land).
Referenties
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Bijlagen
- Presentatie: De basisprincipes van geneesmiddelontdekking en -ontwikkeling
Size: 950,426 bytes, Format: .pptx
De basisprincipes van geneesmiddelontdekking en -ontwikkeling. Gemiddeld duurt het ruim 12 jaar en kost het meer dan 1 miljard euro om al het benodigde onderzoeks- en ontwikkelingswerk te doen voordat een nieuw geneesmiddel beschikbaar komt om door patiënten te worden gebruikt. Deze presentatie gaat nader in op het proces van ontdekking tot marktintroductie van een nieuw geneesmiddel en daarna.
A2-1.02.9-v1.1