Last update: 3 Agosto 2015
Introduzione
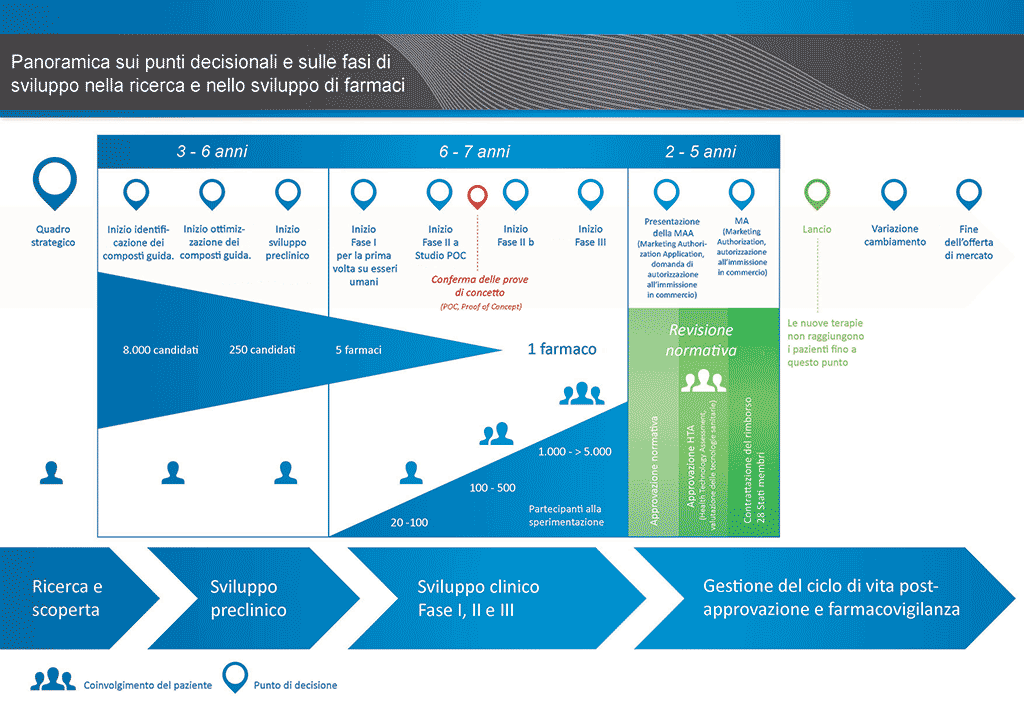
Sono necessari più di 12 anni e in media più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti.
Lo sviluppo di farmaci è un’impresa ad alto rischio. La maggioranza (circa il 98%) delle sostanze sviluppate non riesce ad arrivare sul mercato come nuovo medicinale. Ciò accade soprattutto perché osservando i benefici e i rischi (effetti collaterali negativi) riscontrati durante lo sviluppo, non sono comparabili positivamente rispetto ai farmaci già disponibili per i pazienti.
Lo sviluppo di un nuovo farmaco può essere suddiviso in 10 fasi diverse. Il seguente articolo si occupa della Fase 10: sorveglianza sulla sicurezza durante la commercializzazione e la post-commercializzazione e gestione del ciclo di vita.
- Occorrono oltre 10 anni di attenta pianificazione e ricerca perché un farmaco passi da molecola a trattamento disponibile sul mercato.
Sorveglianza sulla sicurezza durante la commercializzazione e la post-commercializzazione
Il processo di commercializzazione comprende la condivisione delle informazioni relative al nuovo farmaco con i medici e con gli altri operatori sanitari affinché divengano consapevoli degli effetti del nuovo farmaco e possano prescriverlo nei casi in cui ritengano possa essere di beneficio ai pazienti.
Tuttavia, il processo di sviluppo non finisce qui. Vi è ancora bisogno di raccogliere e analizzare le informazioni riguardanti la sicurezza del farmaco quando esso viene utilizzato nella "vita reale" ("farmacovigilanza"). Ciò avviene perché:
- negli studi clinici (che sono progettati per dare risposte chiare) idealmente i pazienti sono solo affetti dalla malattia che viene studiata e non assumono altri farmaci;
- nella vita reale, il nuovo farmaco viene assunto da un gran numero di pazienti, che possono avere parecchie altre malattie e assumere una serie di altri farmaci.
Sia i dati degli studi clinici sia i dati della vita reale sono necessari per comprendere pienamente l'effettivo rapporto rischi-benefici del medicinale.
Gestione del ciclo di vita
Dopo che un farmaco è immesso sul mercato, il processo di sviluppo continua a indagare su:
- altri possibili usi (indicazioni) per il farmaco. Ad esempio, se l'uso iniziale era per pazienti con asma, una nuova indicazione potrebbe essere per pazienti con un diverso tipo di malattia polmonare, ad esempio malattia polmonare ostruttiva cronica.
- modi migliori per produrre e utilizzare il farmaco (nuove formulazioni). Ad esempio, una formulazione speciale per bambini.
Tutte queste attività sono note come "gestione del ciclo di vita".
Altre modifiche nel ciclo di vita di un farmaco
Quando un farmaco è immesso per la prima volta sul mercato, viene protetto da un "brevetto". Ciò vuol dire che le altre aziende non possono commercializzare un farmaco simile. Alla fine del periodo di brevetto o di protezione dei dati, altre aziende fabbricheranno e commercializzeranno il medesimo prodotto. Quando questo avviene, il prodotto viene chiamato "generico".
I nuovi medicinali sono di solito approvati come farmaci soggetti a prescrizione. Ciò significa che gli operatori sanitari possono monitorare il loro uso nei primi anni. Nel caso in cui sia appropriato e sicuro, il farmaco può quindi essere messo a disposizione come farmaco da banco. Questo comporta una modifica della situazione normativa del farmaco ed è necessaria una nuova autorizzazione. I pazienti possono acquistare il farmaco da banco in farmacia o in un supermercato (secondo il paese).
Riferimenti bibliografici
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Allegati
- Scheda informativa: sorveglianza sulla sicurezza durante la commercializzazione e la post-commercializzazione e gestione del ciclo di vita
Size: 98,017 bytes, Format: .docx
Sorveglianza sulla sicurezza durante la commercializzazione e la post-commercializzazione e gestione del ciclo di vita. Questa scheda informativa si occupa delle attività che si verificano dopo che un farmaco ha ricevuto l’autorizzazione dalle autorità di regolamentazione. Includono la commercializzazione, la sorveglianza sulla sicurezza e altre attività relative alla gestione del ciclo di vita.]
- Presentazione: i principi di base relativi alla scoperta e allo sviluppo di farmaci
Size: 877,906 bytes, Format: .pptx
I principi di base relativi alla scoperta e allo sviluppo di farmaci. Sono necessari più di 12 anni e più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti. Questa presentazione spiega in dettaglio il percorso a partire dalla scoperta fino all’immissione sul mercato di un nuovo farmaco e oltre.
A2-1.02.9-v1.1