Last update: 12 stycznia 2016
Wprowadzenie
Ocena wpływu danej technologii wymaga kompleksowych informacji, które odzwierciedlają to, co może mieć miejsce w systemie opieki zdrowotnej lub społeczeństwie. Dobra analiza wymaga użycia specjalistycznych porad i metod pochodzących z różnych dyscyplin, które będą wykorzystane jako dane wejściowe.
Oceny HTA polegają na prowadzeniu analiz porównawczych, w których zestawia się istniejący standard opieki z nową technologią, aby sprawdzić, jakie korzyści się z nią wiążą (tak zwana „wartość dodana”). Oceny HTA są w różny sposób implementowane w różnych krajach, regionach i szpitalach. Dany problem zdrowotny jest rozważany w kontekście lokalnym, a następnie analizuje się leczenie we wskazaniach ustalonych dla leku podczas rejestracji.
Organ HTA bada dostępne dane pod kątem tych wskazań, aby ocenić nowe leczenie w porównaniu z najlepszym standardem opieki (biorąc pod uwagę efektywność kliniczną i bezpieczeństwo). Niektóre organy HTA oceniają także koszty i opłacalność stosowania leku, przy czym jedne przeprowadzają oficjalne oceny etyczne, organizacyjne, społeczne i prawne, a inne po prostu uwzględniają te kwestie bezpośrednio w swojej ocenie.
Każdy organ HTA wyznacza „wartość dodaną” innym, uwzględniającym wiele aspektów sposobem. Wnioski dotyczące „wartości dodanej” mogą się różnić zależnie od organu HTA. W europejskiej sieci HTA (EUnetHTA) opracowano model oceniania „wartości dodanej” tzw. HTA Core Model®.1 HTA Core Model® składa się z dziewięciu obszarów:
- Problem zdrowotny
- Opis techniczny technologii
- Bezpieczeństwo stosowania
- Efektywność kliniczna
- Ocena kosztów i ekonomiki (opłacalność)
- Analiza etyczna
- Aspekty organizacyjne
- Aspekty społeczne
- Aspekty prawne
EUnetHTA zdefiniowała ocenę czterech pierwszych obszarów jako „względną ocenę efektywności”, która polega na przykład na porównaniu nowego leczenia z istniejącym.
Ocena efektywności klinicznej w ocenie technologii medycznych (HTA)
Ocena efektywności klinicznej polega na badaniu oddziaływania nowej technologii na zdrowie pacjentów (w standardowych warunkach klinicznych) w porównaniu z aktualnym standardem opieki. Wpływ technologii na zdrowie jest zwykle analizowany za pomocą dalszych badań wyników związanych ze zdrowiem. Pacjenci chcą mieć dostęp do nowych leków, które:
- ograniczają efekty postrzegane jako „złe” — takie jak ataki serca, hospitalizacje, działania niepożądane i/lub
- zwiększają efekty postrzegane jako „dobre” — takie jak poprawa funkcjonowania i dni bez bólu,
Prowadząc ocenę efektywności klinicznej, organy HTA stosują uznane metody z pokrewnych działów medycyny. W szczególności ocena efektywności klinicznej jest przeprowadzana według zasad zapożyczonych z epidemiologii i medycyny (tzw. epidemiologia kliniczna).
Dobra ocena efektywności klinicznej opiera się na czterech podstawowych zasadach:
- Wyszukiwanie informacji,
- Zadawanie właściwych pytań,
- Wiedza o różnicach i
- ustalenie wartości różnic.
Wyszukiwanie informacji
Organy HTA korzystają z informacji klinicznych do oszacowania, jakie efekty zdrowotne może spowodować u pacjentów przyjęcie nowego leku. Najpierw jedna muszą określić, jak będą gromadzić informacje. Organy HTA mogą uzyskiwać informacje kliniczne o nowych technologiach trzema różnymi sposobami:
- Dokonując przeglądu informacji o działaniu leku,
- Prowadząc nowe badanie, aby zebrać informacje i ocenić działanie leku w rzeczywistych warunkach lub
- Pytając lekarzy i pacjentów („ekspertów”) o ich oczekiwania wobec leku.
Organy HTA często stosują połączenie tych podejść. Na przykład:
- Mogą korzystać z informacji od podmiotu odpowiedzialnego (MAH) w przypadku danej technologii, aby przeprowadzać własne niezależne oceny i analizy.
- W przypadku braku informacji może być potrzeba opinia eksperta — na przykład, aby dowiedzieć się, czy zmiany w wynikach krótkoterminowych (takie jak obniżenie stężenia cholesterolu) mogą być prognostykiem zmian długoterminowych (takich jak brak potrzeby hospitalizacji).
Organy HTA rzadko decydują się na przeprowadzenie nowych badań, ponieważ czas potrzebny na ich przygotowanie i zatwierdzenie jest na ogół za długi. W niektórych wypadkach organy odpowiedzialne zezwalają warunkowo na refundację leku, jednocześnie gromadząc dalsze informacje (podobnie jak w przypadku przyznania przez odnośne władze podmiotowi odpowiedzialnemu warunkowego pozwolenia na dopuszczenie do obrotu, z jednoczesnym zobowiązaniem go do zbierania dalszych informacji). Aby zapewnić pacjentom szybszy dostęp do leku podmiot odpowiedzialny i odpowiedzialny organ mogą podzielić się ryzykiem gorszego niż spodziewane działania leku w warunkach rzeczywistych, wykorzystując w tym celu mechanizmy negocjacji ceny lub inne zmiany warunków refundacji (takie jak ograniczenie populacji pacjentów uprawnionych do refundacji).
Zadawanie właściwych pytań
Analizując efektywność kliniczną nowej technologii zdrowotnej, organ HTA musi starannie rozważyć wszelkie jej wyniki. Znajomość tych wyników jest ważna, ponieważ pozwala zadawać właściwe pytania dotyczące efektywności technologii.
Coraz większa staje się świadomość, że efekty, które mogą wydawać się ważne lekarzom, nie zawsze są najważniejsze dla pacjentów. Z tego powodu ważne jest zaangażowanie pacjentów w projektowanie badań — pozwala mieć pewność, że zbierane informacje dotyczą ważnych dla nich efektów. Na przykład w ostatnich latach dało się zauważyć, że z punktu widzenia pacjenta ważnym efektem jest jakość życia. Doprowadziło to opracowania w ramach badań klinicznych specjalnych metodologii do pomiarów oceny jakości życia i „wyników świadczonych usług medycznych na podstawie opinii pacjentów”.
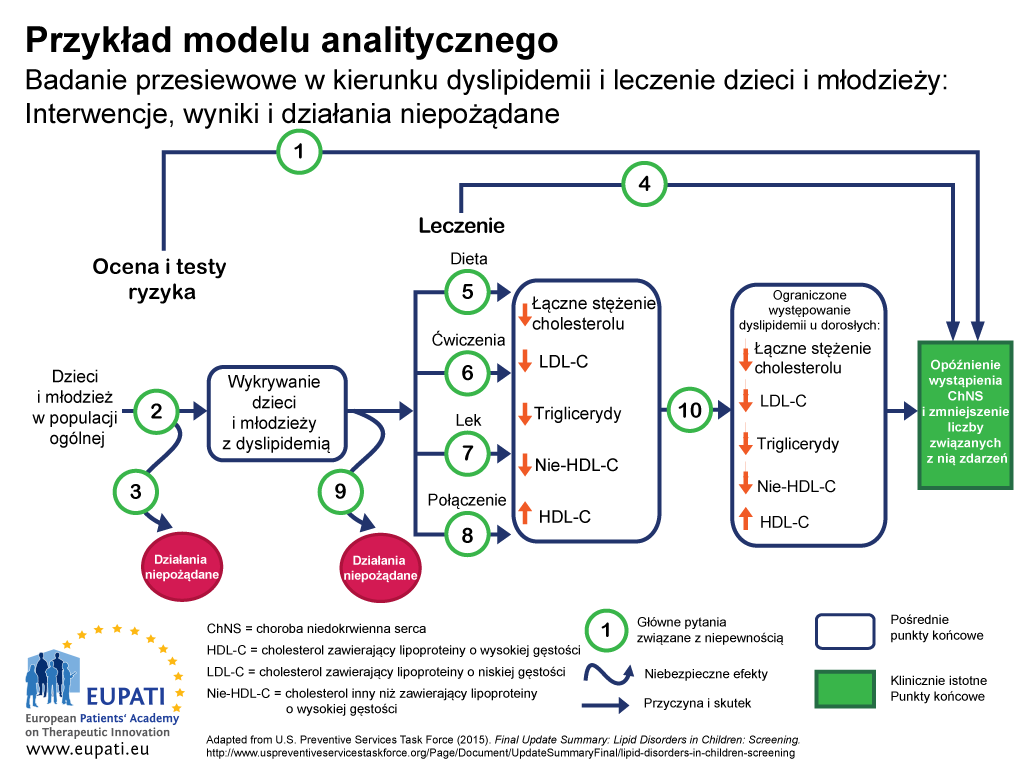
Jedynym podejściem zapewniającym, że wszystkie ważne efekty działania danej technologii zostały zbadane, jest zastosowanie modeli analitycznych, na przykład modelu podobnego do przedstawionego na Ilustracji 1.2 Modele analityczne są przydatne do wizualizacji wszystkich efektów powiązanych z interwencją, a także do podkreślenia miejsc, w których występują niepewności.
Na modelu analitycznym przedstawionym na Ilustracji 1:
- Przyczyna i skutek są przedstawione za pomocą strzałek.
- Zakrzywione strzałki wskazują szkodliwe efekty.
- Efekty pozytywne (takie jak niższa umieralność) są przedstawione za pomocą prostokątów.
- Prostokąty z ostrymi narożnikami przedstawiają klinicznie istotne punkty końcowe (postrzegane przez pacjentów, np. ból w klatce piersiowej)
- Prostokąty z zaokrąglonymi narożnikami przedstawiają pośrednie punkty końcowe, w tym zastępcze (niepostrzegane przez pacjentów, np. stężenie cholesterolu we krwi).
- Główne pytania dotyczące niepewności mogą następnie być przedstawiane liczbowo.
- Ten model analityczny posłużył do wyznaczenia zalet i ograniczeń dowodu dotyczącego efektywności badań przesiewowych dzieci i młodzieży w kierunku dyslipidemii (zaburzeń metabolizmu lipidów) stanowiącego część rutynowej opieki podstawowej. Dyslipidemie są ważnym czynnikiem ryzyka wystąpienia choroby niedokrwiennej serca (ChNS).
Główne pytania dotyczące tego modelu analitycznego:
- Główne pytanie 1: Czy badania przesiewowe pod kątem dyslipidemii u dzieci/młodzieży pozwalają skutecznie opóźniać zachorowanie i ograniczać liczbę zdarzeń związanych z chorobą niedokrwienną serca?
- Główne pytanie 2: Jaka jest dokładność badań przesiewowych pod kątem dyslipidemii w odniesieniu do identyfikacji dzieci/młodzieży, u których występuje podwyższone ryzyko zdarzeń związanych z chorobą niedokrwienną serca i innych?
- Główne pytanie 3: Jakie działania niepożądane wiążą się z badaniami przesiewowymi (w tym wyniki fałszywie dodatnie, fałszywie ujemne, wskazania do stosowania)?
- Główne pytanie 4: Jaka jest w przypadku dzieci i dorosłych efektywność leku, diety, ćwiczeń i terapii łączonej dla ograniczenia występowania dyslipidemii dorosłych i opóźniania zachorowania oraz zmniejszania występowania zdarzeń związanych z chorobą niedokrwienną serca i innych (z uwzględnieniem optymalnego wieku rozpoczęcia leczenia)?
- Główne pytania 5–8: Jaka jest efektywność leku, diety, ćwiczeń i terapii łączonej w leczeniu dyslipidemii u dzieci/młodzieży (z uwzględnieniem dodatkowej korzyści wynikającej z leczenia dyslipidemii w dzieciństwie)?
- Główne pytanie 9: Jakie działania niepożądane wiążą się z lekami, dietą, ćwiczeniami i terapią łączoną w przypadku dzieci/młodzieży?
- Główne pytanie 10: Czy skuteczne leczenie dyslipidemii w dzieciństwie ogranicza ryzyko jej wystąpienia w okresie dorosłości?
- Główne pytanie 11 (bez ilustracji): Jakie są koszty prowadzenia badań przesiewowych w kierunku dyslipidemii u dzieci bez objawów choroby?
Rozumienie różnic pomiędzy wynikami
Po zidentyfikowaniu wszystkich ważnych wyników nadal może pozostać kilka pytań dotyczących porównania efektów nowej technologii ze standardową opieką i innymi istniejącymi metodami leczenia. Wyniki mogą być różnie mierzone lub dwie technologie mogą dawać pozornie podobne wyniki, a dopiero szczegółowa analiza wykaże różnice między nimi.
W przypadkach, w których trudno zmierzyć zidentyfikowane ważne wyniki lub nie były one mierzone wcześniej, naukowcy muszą starannie tworzyć miary, które następnie będzie można odtworzyć w badaniu. Na przykład pacjent chcieć wiedzieć, w jaki sposób lek pomoże mu wrócić do pracy lub wstać z łóżka. Naukowcy mogą tworzyć skale liczbowe do oceny bólu u pacjentów z bólami krzyża. W innych wypadkach, na przykład jeśli w badaniu mierzy się zmianę w parametrach laboratoryjnych, taka zmiana musi być ponownie przełożona na miarę, która więcej mówi pacjentom — na przykład na możliwość powrotu do pracy.
Niekiedy efekt działania nowego leku (na przykład obniżenie ciśnienia krwi) przedstawiany przez producenta za pośrednictwem wyników krótkoterminowych może być zadowalający dla organów rejestracyjnych. Organ HTA będzie musiał przedstawić taki wynik krótkoterminowy w postaci bardziej zrozumiałej dla pacjentów, na przykład jako zmniejszenie ryzyka przedwczesnej śmierci.
Niektóre wyniki mogą wydawać się jasne, ale po głębszej analizie mogą być trudne do interpretacji. Na przykład zmniejszenie ryzyka pięcioletniej umieralności (śmierć w ciągu pięciu lat) o 50% nie oznacza, że lek może zapobiegać przedwczesnej śmierci. Może natomiast oznaczać:
- rozszerzenie przewidywanej długości życia od 4,9 do 5,1 roku (albo gorzej, od 4,99 do 5,01 roku) u niektórych pacjentów lub
- u bardzo niewielu pacjentów wyleczenie choroby, ale nieprzedłużenie życia u wszystkich pozostałych.
Nawet jeśli istniejące miary są istotne dla pacjentów, nadal mogą być trudne do interpretacji. Na przykład badania mogą wskazywać, że nowy lek zmniejsza ryzyko hospitalizacji z powodu zakażenia o 33%. Może to jednak oznaczać różne rzeczy. Na przykład:
- 33 na 100 osób przyjmujących lek, które w innym wypadku byłby hospitalizowane, uniknęło tego (taka sytuacja jest określana jako bezwzględne zmniejszenie ryzyka lub
- możliwość hospitalizacji jest mniejsza o 33% w stosunku do możliwości hospitalizacji pacjentów nieprzyjmujących leku (taka sytuacja jest określana jako względne zmniejszenie ryzyka). Jeśli możliwość hospitalizacji w przypadku nieprzyjmowania nowego leku wynosi 3 na 1000, to 33-procentowa redukcja zmniejsza ją na 2 na 1000. Oznacza to, że korzyść odniesie 1 na 1000 osób przyjmujących lek. Wygląda to całkiem inaczej niż przedstawiona powyżej korzyść dla 33 ze 100 osób.
Ostatecznym problemem dla zrozumienia różnic między nową technologią zdrowotną a standardową opieką jest korzystanie i nieprawidłowe korzystanie z testów statystycznych. Testy statystyczne mają umożliwiać badaczom dowiedzenie się, czy wykryte przez nich różnice są prawdziwe. Ta informacja jest często zgłaszana w postaci p-wartości. Jednak p-wartość nie odzwierciedla wielkości różnicy ani tego, czy jest ona istotna dla pacjentów. Oznacza to, że p-wartość są na ogół bezużyteczne dla pacjentów i decydentów.
Kolejne miary statystyczne to przedziały ufności. Przedziały ufności są bardziej przydatne, ponieważ dają pewien obraz wielkości różnicy pomiędzy nową technologią zdrowotną a standardem opieki. Przedziały ufności odzwierciedlają także wszelkie niepewności dotyczące oszacowań wielkości różnicy. Na przykład raporty dotyczące nowego leku mogą zawierać informacje o zmniejszeniu ryzyka wystąpienia w przyszłości zawału serca o 33% (z 95-procentowym przedziałem ufności od 5 do 45%) w stosunku do aktualnego ryzyka wystąpienia zawału serca.
Ustalenie wartości różnic
Na koniec trzeba dowiedzieć się, jak postrzegać i oceniać różnice między wynikami. Jeśli lek przedłuża życie o 0,2 roku, organy HTA potrzebują jeszcze następujących informacji:
- jak pacjent oceni przedłużenie życia o 0,2 roku, biorąc pod uwagę spodziewane działania niepożądane i inne kwestie,
- czy zyski wszystkich pacjentów są mniej więcej takie same, czy też występują między nimi zasadnicze różnice oraz
- czy wartość tych zysków dla wszystkich pacjentów jest podobna.
Nowy lek, zwiększający przewidywaną długość życia o średnio 0,2 roku może być różnie postrzegany, jeśli u jednych pacjentów zadziałał, a u innych nie, w przypadku porównania z sytuacją, w której wszyscy pacjenci zyskują 0,2 roku życia, a różnice między nimi są niewielkie.
Istnieje kilka mechanizmów, które można wykorzystać do uzyskania wiedzy na temat względnej wartości, przypisywanej przez pacjentów i producentów różnicom w wynikach dotyczących stanu zdrowia. Jednym z nich są badania jakościowe, na przykład ankiety lub grupy fokusowe, których celem jest dostarczenie informacji o wynikach najważniejszych dla pacjentów. Innym jest badanie ilościowe z wykorzystaniem ankiet dla pacjentów, którzy mogą przypisać dokładne wartości liczbowe do znaczenia przypisywanego różnym stanom zdrowia.
Krótko mówiąc, ocena klinicznej efektywności leku powinna odpowiadać na następujące pytania:
- Na ile wyczerpujące były informacje?
- Na ile dokładne są informacje?
- Czy czegoś brakuje?
- Na ile zrozumiałe są informacje?
Piśmiennictwo
- HTA Core Model. Retrieved 7 December, 2015, from http://www.eunethta.eu/hta-core-model
- U.S. Preventive Services Task Force (2015). Final Update Summary: Lipid Disorders in Children: Screening. Retrieved 7 December, 2015, from: http://www.uspreventiveservicestaskforce.org/Page/Document/UpdateSummaryFinal/lipid-disorders-in-children-screening
A2-6.03.1-v1.1