Last update: 12 januar 2016
Introduktion
En vurdering af en hvilken som helst teknologis indvirkning kræver omfattende information, som afspejler, hvad der sandsynligvis vil ske i et sundhedssystem eller samfund. En god analyse kræver, at man benytter ekspertrådgivning og metoder fra de forskellige discipliner, der anvendes som input.
MTV-vurderinger er komparative analyser, som sammenligner den eksisterende standardbehandling med den nye teknologi for at se, hvilken værdi den nye teknologi ville give (den såkaldte „merværdi‟). Lande, regioner og hospitaler foretager MTV-vurderinger på forskellige måder. De tager alle højde for sundhedsproblemet i deres lokale kontekst og vurderer så behandlingen for den indikation, som lægemiddelmyndighederne har godkendt lægemidlet til.
Inden for denne indikation undersøger MTV-organerne de tilgængelige data for at vurdere, hvor godt behandlingen kan virke sammenlignet med den bedste standardbehandling (med hensyn til sikkerhed og klinisk effektivitet). Nogle MTV-organer vurderer også et lægemiddels omkostninger og omkostningseffektivitet. Mens nogle foretager formelle vurderinger af de etiske, organisatoriske, sociale og juridiske aspekter, er der andre, som blot tager disse aspekter implicit i betragtning i deres vurdering.
De enkelte MTV-organer fastlægger en teknologis „merværdi‟ på forskellige, mangeartede måder. Konklusionerne om en teknologis „merværdi‟ kan variere mellem de forskellige MTV-organer. Det europæiske MTV-netværk (EUnetHTA) har udviklet en ramme, som „merværdien‟ kan vurderes ud fra, og som kaldes HTA Core Model®.1 Der er ni områder i denne HTA Core Model®:
- Sundhedsproblem
- Teknisk beskrivelse af teknologien
- Sikkerhed
- Klinisk effektivitet
- Omkostningsvurdering og økonomisk vurdering (omkostningseffektivitet)
- Etisk analyse
- Organisatoriske aspekter
- Sociale aspekter
- Juridiske aspekter
EUnetHTA har defineret vurderingen af de første fire områder som en „vurdering af den relative effektivitet‟ – hvor man f.eks. sammenligner en ny behandling med den eller de eksisterende behandling(er).
Vurdering af den kliniske effektivitet i MTV
Med en vurdering af den kliniske effektivitet undersøges effekten af en ny teknologi på patienternes helbred i et klinisk standardmiljø sammenlignet med effekten ved den nuværende standardbehandling. Den indvirkning, som en teknologi har på helbredet, analyseres som regel ved hjælp af en yderligere undersøgelse af helbredsresultaterne. Patienterne ønsker at få adgang til nye lægemidler, som:
- reducerer de resultater, der anses for at være „dårlige‟ – såsom hjerteanfald, hospitalsindlæggelser og bivirkninger, og/eller
- øger de resultater, der anses for at være „gode‟ – såsom forbedret funktion og smertefrie dage.
Under vurderingen af den kliniske effektivitet anvender MTV-organerne etablerede metoder fra tilknyttede discipliner inden for lægevidenskaben. Vurderingen af den kliniske effektivitet foretages navnlig efter nogle principper, som er lånt fra epidemiologi og medicin (kaldet for „klinisk epidemiologi‟).
Der er fire underliggende principper for en god vurdering af den kliniske effektivitet:
- Informationssøgning
- Relevante spørgsmål
- Forståelse af forskellene og
- Vurdering af forskellene.
Informationssøgning
MTV-organerne bruger klinisk information til at estimere, hvilke helbredsresultater patienterne kan forvente, når de får et nyt lægemiddel. Først skal de dog beslutte, hvordan de vil indsamle informationen. Der er tre forskellige måder, som MTV-organerne kan indhente klinisk information om nye teknologier på:
- Gennemgang af eksisterende information om lægemidlets præstation
- Udførelse af en ny undersøgelse for at indsamle information og vurdere lægemidlets præstation i en virkelig situation eller
- Spørgsmål til klinikere og patienter („eksperter‟) om, hvilke forventninger de har til lægemidlet.
MTV-organerne benytter ofte en kombination af disse metoder. F.eks.:
- De kan bruge information fra indehaveren af markedsføringstilladelse (Marketing Authorisation Holder; MAH) til teknologien som informationsgrundlag for deres egne uafhængige gennemgange og analyser.
- Når der mangler information, kan det være nødvendigt med en ekspertudtalelse – f.eks. for at finde ud af, om ændringer i resultaterne på kort sigt (såsom en reduktion af kolesteroltallet) kan sige noget om ændringer i resultaterne på længere sigt (såsom undgåelse af hospitalsindlæggelse).
MTV-organerne bestiller sjældent nye undersøgelser, eftersom det typisk tager for lang tid at tilrettelægge en undersøgelse og få den godkendt. I nogle tilfælde har de ansvarlige organer givet tilladelse til, at et lægemiddel får tilskud, på betingelse af at der indsamles yderligere information (hvilket svarer til, at lægemiddelmyndighederne giver en betinget markedsføringstilladelse (Marketing Authorisation; MA), under forudsætning af at der indhentes yderligere information). Risikoen for, at et nyt lægemiddel præsterer dårligere end forventet i den virkelige verden, kan så deles mellem indehaveren af markedsføringstilladelsen og det ansvarlige organ ved hjælp af prisforhandlingsmekanismer eller andre ændringer i de betingelser, der er forbundet med medicintilskud (f.eks. yderligere begrænsninger af den patientpopulation, der kan få tilskud til lægemidlet), alt imens patienterne får hurtigere adgang.
Relevante spørgsmål
Når den kliniske effektivitet af en ny medicinsk teknologi skal vurderes, skal MTV-organet omhyggeligt tage højde for alle de resultater, der er forbundet hermed. Det er vigtigt at kende disse resultater for at kunne stille de relevante spørgsmål om teknologiens effektivitet.
Der er en stadig størrelse forståelse af, at de resultater, som klinikerne anser for vigtige, ikke altid er dem, patienterne betragter som de vigtigste. Derfor er det vigtigt, at patienterne inddrages i undersøgelsernes design, så man sikrer, at der indsamles information om de resultater, der er vigtige for dem. I de senere år er det f.eks. blevet anerkendt, at livskvaliteten er et vigtigt resultat for patienterne. Det har ført til udviklingen af specifikke metoder til at måle livskvalitet og såkaldte „patientrapporterede oplysninger‟ („patient‑reported outcomes‟) i de kliniske undersøgelser.
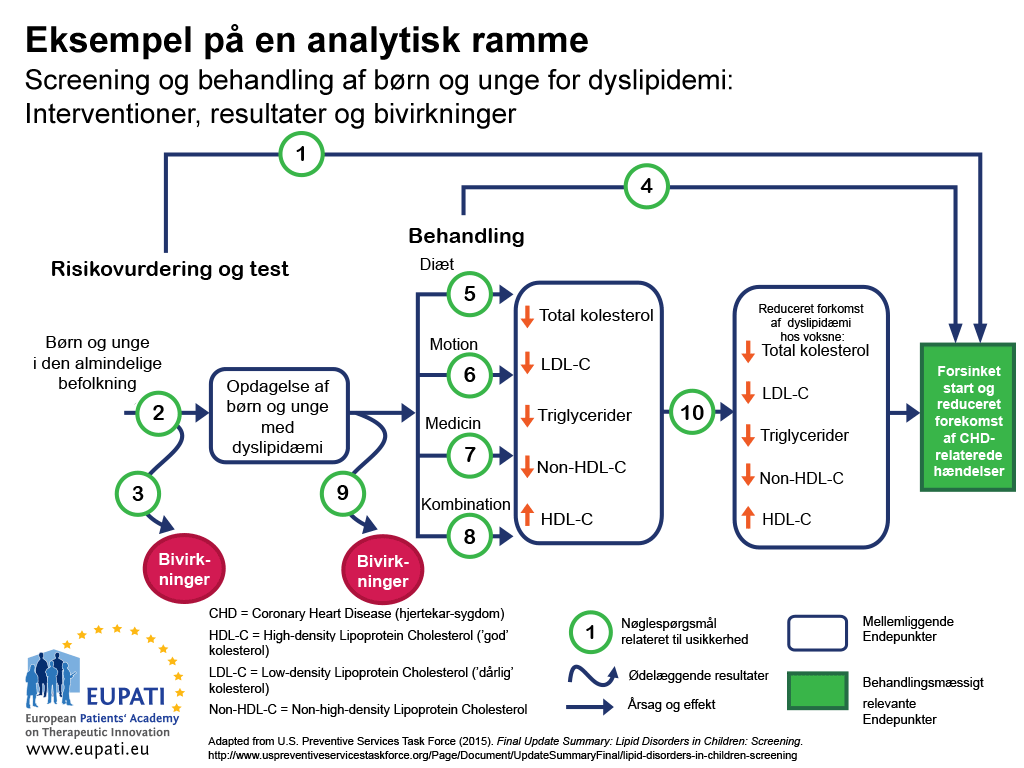
En metode til at sikre, at alle vigtige resultater af en bestemt teknologi bliver undersøgt, er at bruge en analyseramme – f.eks. et flowdiagram som vist i figur 1.2 Analyserammer er nyttige til at vise alle de resultater, der er forbundet med en intervention, og til at understrege, hvor der er usikkerheder.
I analyserammen i figur 1 gælder følgende:
- Årsag og virkning vises med pile.
- Buede pile indikerer negative resultater.
- Resultater, der viser helbredsforbedringer (såsom nedsat dødelighed), er angivet med rektangler.
- Rektangler med skarpe hjørner viser klinisk relevante endepunkter (som kan opfattes af patienten, såsom brystsmerter).
- Rektangler med runde hjørner viser mellemliggende endepunkter, herunder surrogatendepunkter (som ikke kan opfattes af patienten, f.eks. kolesterolniveauet i blodet).
- Nøglespørgsmål, der er relateret til usikkerheden, kan så vises numerisk.
- Denne analyseramme blev anvendt til at fastlægge styrker og begrænsninger ved evidensen for effektiviteten af at screene børn og unge for dyslipidæmi (forstyrrelser i fedtmetabolismen) som et led i den primære rutinebehandling. Dyslipidæmi er en vigtig risikofaktor for koronar hjertesygdom (coronary heart disease; CHD).
De nøglespørgsmål, som vedrører denne analyseramme, er følgende:
- Nøglespørgsmål 1: Er screening for dyslipidæmi hos børn/unge effektivt til at give en senere indtræden og en reduceret incidens af hændelser relateret til koronar hjertesygdom (coronary heart disease; CHD)?
- Nøglespørgsmål 2: Hvor præcis er screening for dyslipidæmi, når det gælder om at identificere børn/unge med øget risiko for koronar hjertesygdom-relaterede hændelser og andre udfald?
- Nøglespørgsmål 3: Hvad er bivirkningerne ved screening (herunder falsk positive resultater, falsk negative resultater og mærkning)?
- Nøglespørgsmål 4: Hvor effektivt er medicin, diæt, motion og kombinationsbehandling hos børn og unge til at reducere incidensen af dyslipidæmi hos voksne samt give en senere indtræden og en reduceret incidens af koronar hjertesygdom-relaterede hændelser og andre udfald (herunder den optimale alder for behandlingsstart)?
- Nøglespørgsmål 5-8: Hvor effektivt er medicin, diæt, motion og kombinationsbehandling til at behandle dyslipidæmi hos børn/unge (herunder den ekstra fordel ved at behandle dyslipidæmi i barndommen)?
- Nøglespørgsmål 9: Hvad er bivirkningerne af medicin, diæt, motion og kombinationsbehandling hos børn/unge?
- Nøglespørgsmål 10: Mindskes risikoen for dyslipidæmi som voksen ved at forbedre dyslipidæmien i barndommen?
- Nøglespørgsmål 11 (ikke afbildet): Hvilke omkostninger er der forbundet med at screene for dyslipidæmi hos asymptomatiske børn?
Forståelse af forskellene mellem resultaterne
Når alle vigtige resultater er identificeret, kan der stadig være adskillige udfordringer med at sammenligne virkningen af en ny teknologi med standardbehandlingen og andre eksisterende behandlinger. Resultaterne kan måles på forskellige måder, og to teknologier kan se ud, som om de har de samme resultater, indtil en nærmere undersøgelse viser forskellene.
Såfremt vigtige identificerede resultater er vanskelige at måle eller aldrig er blevet målt før, skal forskerne omhyggeligt skabe en målemetode, der kan gengives i en undersøgelse. F.eks. vil patienterne måske gerne vide, hvordan et lægemiddel kan hjælpe dem med at vende tilbage til arbejdet eller komme ud af sengen. Forskerne kan udvikle en numerisk smertevurderingsskala til patienter med lænderygsmerter. I andre tilfælde, f.eks. hvis en undersøgelse måler en ændring i et laboratorieparameter, skal denne ændring kunne komme til udtryk som en måling, der er vigtigere for patienterne – f.eks. evnen til at vende tilbage til arbejdet.
Nogle gange kan lægemiddelmyndighederne, som godkender lægemidlerne, være tilfredse med, at lægemiddelfabrikanten påviser et nyt lægemiddels virkning ved hjælp af et kortsigtet resultat, såsom et fald i blodtrykket. Et MTV-organ skal sørge for, at dette kortsigtede resultat kommer til udtryk i et mere patientrelevant resultat, såsom undgåelse af tidlig død.
Nogle resultater synes at være intuitive, men ved nærmere undersøgelse viser de sig at være vanskelige at fortolke. F.eks. betyder en reduktion af risikoen for femårsdødelighed (dødsfald inden for fem år) med 50 % ikke, at lægemidlet kan forebygge tidlig død. Det kunne ganske enkelt tænkes, at lægemidlet:
- forlænger den forventede levetid fra 4,9 til 5,1 år (eller, værre endnu, fra 4,99 år til 5,01 år) hos nogle patienter eller
- helbreder sygdommen hos meget få, men overhovedet ikke forlænger livet hos andre.
Selv om der observeres forskelle i målinger, som er vigtige for patienterne, kan disse stadig være vanskelige at fortolke. F.eks. kan undersøgelser vise, at et nyt lægemiddel reducerer risikoen for hospitalsindlæggelse som følge af en infektion med 33 %. Dette kan dog betyde forskellige ting. Det kunne betyde:
- at 33 ud af 100 personer, som tager lægemidlet, og som ellers ville have været indlagt, undgik hospitalsindlæggelse (dette kaldes en absolut reduktion i risikoen), eller
- at sandsynligheden for hospitalsindlæggelse reduceres med 33 % i forhold til sandsynligheden for hospitalsindlæggelse uden medicin (dette kaldes en relativ reduktion i risikoen). Hvis sandsynligheden for hospitalsindlæggelse uden det nye lægemiddel er 3 ud af 1.000, så mindsker en reduktion på 33 % dette tal til 2 ud af 1.000. Det betyder, at 1 ud af hver 1.000 personer, der tager lægemidlet, vil drage fordel af det. Det er et noget andet resultat end de 33 ud af 100 personer, som drager fordel af lægemidlet i eksemplet ovenfor.
En sidste udfordring, når det gælder om at forstå forskellene mellem en ny medicinsk teknologi og standardbehandlingen, er brug og misbrug af statistiske test. Statistiske test har til formål at hjælpe forskerne med at finde ud af, om det er sandsynligt, at de forskelle, de har opdaget, er reelle. Dette rapporteres ofte i form af en p-værdi. P-værdier afspejler dog ikke forskellens omfang (størrelse), eller om denne forskel er betydningsfuld for patienterne. Derfor er p-værdier generelt ikke så nyttige for patienter og udbydere, der skal træffe beslutninger.
Andre statistiske målemetoder er konfidensintervaller. Konfidensintervaller er mere nyttige, fordi de giver en vis forståelse af størrelsen på forskellen mellem den nye medicinske teknologi og standardbehandlingen. Konfidensintervaller afspejler også en eventuel usikkerhed omkring forskellens estimerede omfang. F.eks. kan et nyt lægemiddel være rapporteret til at mindske sandsynligheden for et fremtidigt hjerteanfald med 33 % (med et 95 %-konfidensinterval på mellem 5 % og 45 %) i forhold til den nuværende sandsynlighed for at få et hjerteanfald.
Vurdering af forskellene
Den sidste udfordring er at forstå, hvordan forskellene mellem resultaterne skal opfattes og vurderes. Hvis et lægemiddel forlænger livet med 0,2 år, har MTV-organerne stadig brug for at vide:
- hvor meget en patient ville værdsætte 0,2 ekstra leveår i betragtning af de forventede bivirkninger og andre bekymringer
- om alle patienter oplever nogenlunde de samme gevinster, eller om der er tydelige forskelle hos patienterne, og
- om alle patienter vurderer disse gevinster på samme måde.
Et nyt lægemiddel, der forlænger den forventede levetid med 0,2 år, vil blive opfattet forskelligt, hvis det virker hos nogle patienter, men ikke har nogen virkning hos andre, når det sammenlignes med et scenario, hvor alle patienter får 0,2 ekstra leveår uden den store forskel mellem patienterne.
Der er flere mekanismer, der kan bruges til at forstå den relative værdi, som patienter og udbydere tillægger forskellene i helbredsresultaterne. En af dem er kvalitativ forskning, såsom undersøgelser eller fokusgrupper, der har til formål at give en forståelse af, hvilke resultater der er vigtigst for patienterne. En anden mekanisme er kvantitativ forskning baseret på undersøgelser hos patienter, som sætter en præcis numerisk værdi på den betydning, de forskellige helbredstilstande tillægges.
I en vurdering af den kliniske effektivitet skal man kort sagt tage følgende spørgsmål op:
- Hvor omfattende var informationen?
- Hvor nøjagtig er informationen?
- Mangler der noget?
- Hvor forståelig er informationen?
Referencer
- HTA Core Model. Retrieved 7 December, 2015, from http://www.eunethta.eu/hta-core-model
- U.S. Preventive Services Task Force (2015). Final Update Summary: Lipid Disorders in Children: Screening. Retrieved 7 December, 2015, from: http://www.uspreventiveservicestaskforce.org/Page/Document/UpdateSummaryFinal/lipid-disorders-in-children-screening
A2-6.03.1-v1.1