Last update: 12 Gennaio 2016
Introduzione
La valutazione dell’impatto di qualsiasi tecnologia richiede informazioni complete che rispecchino ciò che potrebbe succedere in un sistema sanitario o in una società. Una buona analisi richiede la consulenza di esperti e l’impiego di metodi tratti da varie discipline e utilizzati come punto di partenza.
Le valutazioni HTA sono analisi comparative che confrontano lo standard di cura esistente con la nuova tecnologia per identificare quale valore la nuova tecnologia potrebbe apportare (il cosiddetto ‘valore aggiunto’). I paesi, le regioni e gli ospedali implementano le valutazioni HTA in modi diversi. Tutti considereranno il problema sanitario nel loro contesto locale e quindi valuteranno il trattamento per l’indicazione che gli enti regolatori hanno accettato per il medicinale.
Nell’ambito di tale indicazione gli organismi HTA esaminano i dati disponibili per valutare i vantaggi del trattamento rispetto al migliore standard di cura (in termini di sicurezza ed efficacia clinica). Alcuni organismi HTA valutano anche i costi e il rapporto costi-benefici di un medicinale, e mentre alcuni fanno valutazioni formali degli aspetti etici, organizzativi, sociali e legali, altri organismi considerano solo implicitamente questi aspetti nelle loro valutazioni.
Il ‘valore aggiunto’ di una tecnologia viene determinato da ogni organizzazione HTA in modo differente, sotto molteplici aspetti. Le conclusioni relative al ‘valore aggiunto’ di una tecnologia possono differire tra i diversi organismi HTA. La rete europea degli HTA (EUnetHTA) ha sviluppato un modello con il quale è possibile valutare il ‘valore aggiunto’, denominato HTA Core Model®.1 L’HTA Core Model® prevede nove ambiti:
- Problema sanitario
- Descrizione tecnica della tecnologia
- Sicurezza
- Efficacia clinica
- Costi e valutazione economica (rapporto costi-benefici)
- Analisi etica
- Aspetti organizzativi
- Aspetti sociali
- Aspetti legali
L’EUnetHTA ha definito la valutazione per i primi quattro ambiti come una ‘valutazione relativa dell’efficacia’ – in cui, ad esempio, un nuovo trattamento viene confrontato con il(i) trattamento(i) esistente(i).
Valutazione dell’efficacia clinica in HTA
Una valutazione dell’efficacia clinica esamina l’effetto di una nuova tecnologia sulla salute dei pazienti in un ambiente clinico standard, comparandolo a quello dell’attuale standard di cura. L’impatto che una tecnologia ha sulla salute viene solitamente analizzato attraverso un ulteriore esame dei risultati per la salute. I pazienti desiderano poter accedere a nuovi medicinali che:
- riducono i risultati che vengono percepiti come ‘cattivi’ – ad esempio attacco di cuore, ricovero ospedaliero, e effetti collaterali, e/o
- accrescono i risultati che vengono percepiti come ‘buoni’ – ad esempio una maggiore funzionalità e giornate senza dolore.
Durante una valutazione dell’efficacia clinica, gli organismi HTA utilizzano metodi definiti tratti da discipline mediche associate. In particolare, la valutazione dell’efficacia clinica viene eseguita con principi tratti dall’epidemiologia e dalla medicina (denominata ‘epidemiologia clinica’)
I principi base per una buona valutazione dell’efficacia clinica sono quattro:
- Ricercare le informazioni,
- Porre le relative domande,
- Comprendere le differenze, e
- Valutare le differenze.
Ricercare le informazioni
Gli organismi HTA utilizzano le informazioni cliniche per valutare quali risultati di salute i pazienti possono provare quando gli viene somministrato il medicinale. In primo luogo devono tuttavia decidere come raccoglieranno le informazioni. Esistono tre modi differenti con cui gli organismi HTA possono ottenere informazioni cliniche sulle nuove tecnologie:
- Rivedere informazioni esistenti sulla performance del medicinale,
- Eseguire un nuovo studio per raccogliere informazioni e valutare la performance del medicinale in un quadro di vita reale, o
- Chiedere a medici e pazienti (‘esperti’) cosa si aspettano dal medicinale.
Gli organismi HTA utilizzano spesso una combinazione di questi approcci. Ad esempio:
- Potrebbero utilizzare le informazioni di un titolare dell’autorizzazione all’immissione in commercio (MAH, Marketing Authorisation Holder) della tecnologia per rendere note le loro revisioni e analisi indipendenti.
- Quando mancano le informazioni, può essere richiesta l’opinione di esperti – ad esempio per scoprire se cambiamenti dei risultati a breve termine (come abbassamento del colesterolo) possono far prevedere cambiamenti dei risultati a lungo termine (come evitare il ricovero ospedaliero).
Gli organismi HTA assegnano raramente l’incarico di eseguire nuovi studi, poiché il tempo necessario per realizzare e far approvare uno studio è generalmente troppo lungo. In alcuni casi, gli organismi responsabili hanno accordato con riserva il rimborso di un medicinale, sulla base della raccolta di ulteriori informazioni (ciò equivarrebbe a un’autorizzazione con riserva all’immissione sul mercato (MA – Marketing Authorisation) da parte delle autorità di regolamentazione con richiesta di raccogliere ulteriori informazioni). Il rischio che un nuovo medicinale abbia nella realtà una performance inferiore a quella attesa può essere condiviso tra l’MAH e l’organismo responsabile attraverso meccanismi di trattativa del prezzo o altri cambiamenti alle condizioni associate all’accesso rimborsato (come ulteriori restrizioni alla popolazione di pazienti aventi diritto a ricevere un accesso rimborsato) mentre ai pazienti viene accordato un accesso più immediato.
Porre le relative domande
Valutando l’efficacia clinica di una nuova tecnologia sanitaria, l’organismo HTA deve considerare attentamente tutti i risultati associati ad essa. È importante conoscere questi risultati al fine di porre le relative domande circa l’efficacia della tecnologia.
Cresce sempre più l’impressione che i risultati che possono sembrare importanti ai medici, non sono sempre quelli considerati più importanti dai pazienti. Per tale motivo, è importante per i pazienti essere coinvolti nella pianificazione degli studi, per essere certi che le informazioni raccolte sugli esiti siano importanti per loro. Ad esempio, negli ultimi anni si è riconosciuto che la qualità della vita è un risultato importante per i pazienti. Ciò ha portato allo sviluppo di metodologie specifiche per creare misure di valutazione della qualità della vita e i cosiddetti ‘esiti riferiti dal paziente’ nell’ambito degli studi clinici.
Un approccio per assicurare che tutti i risultati importanti di una tecnologia specifica siano esaminati consiste nell’utilizzare uno schema analitico – ad esempio un diagramma di flusso del tipo rappresentato nella figura 1.2 Gli schemi analitici sono utili per visualizzare tutti i risultati associati con un intervento, e per evidenziare dove esistono incertezze.
Nello schema analitico in figura 1:
- Causa ed effetto sono rappresentati con frecce.
- Frecce curve indicano i risultati pericolosi.
- I risultati che comportano un miglioramento della salute (come una diminuzione della mortalità) sono rappresentati con dei rettangoli.
- I rettangoli con angoli retti indicano gli endpoint clinicamente importanti (quelli percepiti dal paziente, come ad esempio un dolore al petto)
- I rettangoli con angoli arrotondati indicano gli endpoint intermedi, inclusi endpoint surrogati (che non possono essere percepiti dal paziente, come ad esempio il livello di colesterolo nel sangue).
- Le domande chiave relative all’incertezza possono essere poi indicate numericamente.
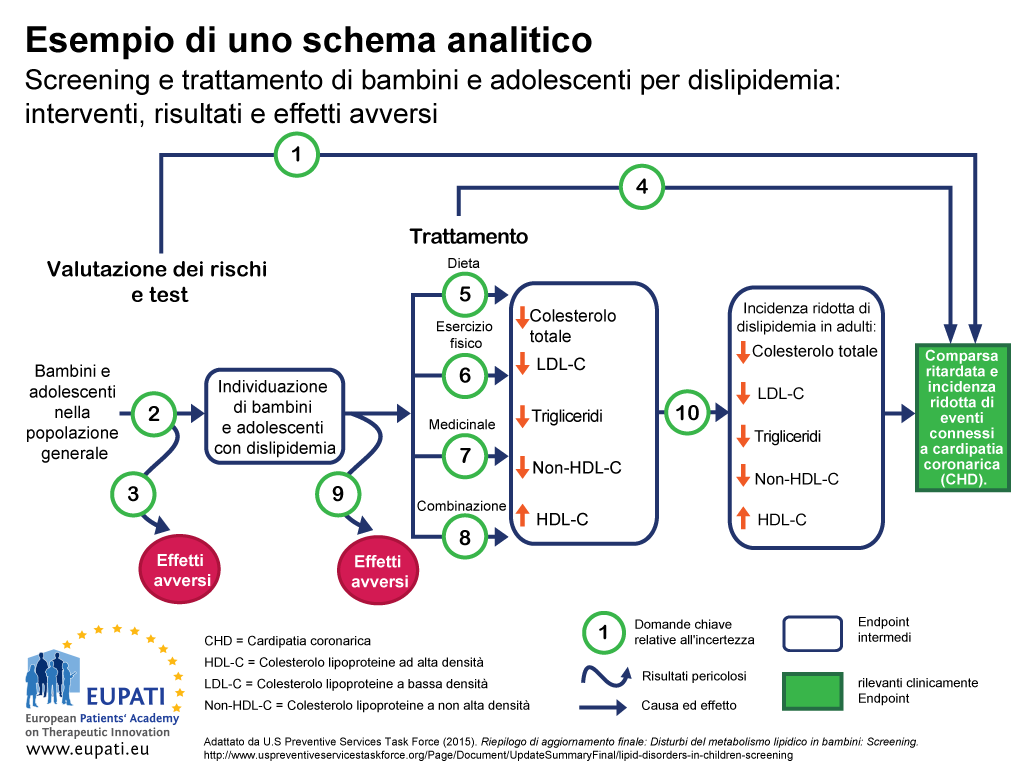
Questo quadro analitico è stato utilizzato per determinare i punti di forza e le limitazioni delle prove sull’efficacia dello screening dei bambini e degli adolescenti per la dislipidemia (disturbi del metabolismo dei lipidi) come parte della normale assistenza primaria. Le dislipidemie sono importanti fattori di rischio per le malattie cardiache coronariche (CHD).
Le domande chiave relative a questo schema analitico sono le seguenti:
- Domanda chiave 1: Lo screening per la dislipidemia in bambini/adolescenti è efficace per ritardare la comparsa e ridurre l’incidenza di eventi connessi a CHD (cardiopatia coronarica)?
- Domanda chiave 2: Qual è l’accuratezza dello screening per la dislipidemia nell’identificazione di bambini/adolescenti a maggior rischio di eventi connessi a CHD o altri risultati?
- Domanda chiave 3: Quali sono gli effetti avversi dello screening (inclusi falsi positivi, falsi negativi, etichettatura)?
- Domanda chiave 4: In bambini e adolescenti qual è l’efficacia del farmaco, della dieta, dell’esercizio fisico, di una terapia di combinazione nel ridurre l’incidenza della dislipidemia da adulto, e nel ritardare la comparsa e ridurre l’incidenza di eventi connessi a CHD e altri risultati (inclusa l’età ideale per iniziare il trattamento)?
- Domande chiave 5-8: Qual è l’efficacia del farmaco, della dieta, dell’esercizio fisico, di una terapia di combinazione nel trattamento della dislipidemia in bambini/adulti (incluso il beneficio incrementale di trattare la dislipidemia nell’infanzia)?
- Domanda chiave 9: Quali sono gli effetti avversi del medicinale, della dieta, dell’esercizio fisico, e della terapia di combinazione nei bambini/adolescenti?
- Domanda chiave 10: Il miglioramento della dislipidemia nell’infanzia riduce il rischio di dislipidemia nell’età adulta?
- Domanda chiave 11: (non in figura): Quali sono le voci di costo derivanti dallo screening per la dislipidemia in bambini asintomatici?
Comprendere le differenze tra i risultati
Una volta che tutti i risultati importanti sono stati identificati, possono esserci ancora diverse difficoltà nel confrontare gli effetti di una nuova tecnologia con lo standard di cura e altri trattamenti esistenti. I risultati possono essere valutati in diversi modi, oppure può sembrare che due tecnologie diano risultati simili prima che un esame più ravvicinato evidenzi le differenze.
In casi in cui i risultati importanti identificati sono difficili da valutare, o non sono mai stati valutati prima, gli scienziati devono creare accuratamente una misura che può essere poi riprodotta in uno studio. Ad esempio, un paziente può voler sapere come un medicinale lo aiuterà a ritornare al lavoro o a alzarsi dal letto. Gli scienziati possono creare una scala numerica di valutazione del dolore per pazienti con dolori dorso-lombari. In altri casi, ad esempio in cui uno studio valuta un cambiamento in un parametro di laboratorio, questo cambiamento deve essere re-interpretato in una misura che è maggiormente importante per i pazienti – ad esempio la capacità di ritornare al lavoro.
Talvolta le autorità di regolamentazione che approvano i medicinali possono essere soddisfatte con un produttore del medicinale che dimostra l’effetto di un nuovo medicinale sulla base di un risultato a breve termine, come ad esempio l’abbassamento della pressione arteriosa. Un organismo HTA avrà bisogno di reinterpretare quel risultato a breve termine in risultati più importanti per il paziente, come ad esempio evitare una morte prematura.
Alcuni risultati possono sembrare intuitivi ma, ad un esame ravvicinato, possono essere difficili da interpretare. Ad esempio, una riduzione del rischio di mortalità a cinque anni (morte entro cinque anni) del 50% non significa che un medicinale può prevenire una morte prematura. Potrebbe semplicemente trattarsi di:
- prolungare le aspettative di vita da 4,9 a 5,1 anni (o nel caso peggiore, da 4,99 anni a 5,01 anni) in alcuni pazienti, o
- curare la malattia in pochi ma non prolungare in alcun modo la vita in altri.
Anche se si osservano differenze nelle valutazioni che sono significative per i pazienti, esse possono essere ancora difficili da interpretare. Ad esempio, degli studi possono indicare che un nuovo medicinale ha ridotto il rischio di ricovero ospedaliero da infezione del 33% Tuttavia, ciò può significare cose differenti. Potrebbe significare che:
- 33 su 100 persone che hanno assunto il medicinale e che sarebbero state altrimenti ricoverate in ospedale hanno evitato il ricovero (ciò viene indicato come una riduzione assoluta del rischio), oppure
- la probabilità di ricovero in ospedale è ridotta del 33% rispetto alla probabilità di essere ricoverato senza medicinale (ciò viene indicato come una riduzione relativa del rischio). Se la probabilità di essere ricoverato in ospedale in assenza del nuovo medicinale è di 3 su 1.000, una riduzione del 33% la riduce a 2 su 1.000. Ciò significa che 1 su ogni 1.000 persone che assumono il medicinale ne avranno beneficio. È un significato ben differente rispetto alle 33 persone su 100 che beneficiano del medicinale nell’esempio precedente.
Un’ultima difficoltà nel comprendere le differenze tra una nuova tecnologia sanitaria e lo standard di cura è costituita dall’uso e dal cattivo uso dei test statistici. I test statistici sono destinati ad aiutare i ricercatori a capire se le differenze che hanno individuato possono essere reali. Ciò è spesso riferito sotto forma di un valore p. Tuttavia i valori p non rispecchiano l’entità (dimensione) della differenza o se quella differenza è significativa per i pazienti. Ciò significa che generalmente i valori p non sono utili per i pazienti e gli operatori che prendono le decisioni.
Altre valutazioni statistiche comprendono intervalli di confidenza. Gli intervalli di confidenza sono più utili poiché danno un senso alla dimensione della differenza tra la nuova tecnologia sanitaria e lo standard di cura. Gli intervalli di confidenza rispecchiano anche un’incertezza circa la stima dell’entità della differenza. Ad esempio, un nuovo medicinale può essere indicato come in grado di ridurre del 33% la possibilità di avere un attacco cardiaco in futuro (con un 95% di intervallo di confidenza del 5% – 45%) rispetto all’attuale possibilità di avere un attacco cardiaco.
Valutare le differenze
L’ultima difficoltà è costituita dal comprendere come percepire e valutare le differenze tra i risultati. Se un medicinale prolunga la vita di 0,2 anni, gli organismi HTA devono ancora sapere:
- il valore che un paziente attribuirebbe a 0,2 anni di vita addizionale considerando gli effetti collaterali attesi e altri problemi,
- se tutti i pazienti vivono più o meno gli stessi vantaggi o se ci sono differenze considerevoli tra i pazienti, e
- se tutti i pazienti valutano in modo simile questi vantaggi.
Un nuovo medicinale che accresce mediamente l’aspettativa di vita di 0,2 anni verrebbe percepito in modo diverso se agisce in alcuni pazienti ma non ha alcun effetto su altri, se confrontato con uno scenario in cui tutti i pazienti hanno guadagnato 0,2 anni di vita con differenze minime tra i pazienti.
Esistono diversi meccanismi che possono essere utilizzati per comprendere il valore relativo che i pazienti e gli operatori attribuiscono a differenze nei risultati sulla salute. Uno è costituito dalla ricerca qualitativa, come sondaggi o gruppi di discussione, nell’intento di comprendere quali risultati sono più importanti per i pazienti. Un altro è costituito dalla ricerca quantitativa basata su sondaggi tra i pazienti che possono assegnare valori numerici precisi all’importanza data a diversi stati di salute.
Riassumendo, una valutazione dell’efficacia clinica dovrebbe rispondere alle seguenti domande:
- Quanto erano complete le informazioni?
- Quanto erano accurate le informazioni?
- Manca qualcosa?
- Quanto sono comprensibili le informazioni?
Riferimenti bibliografici
- HTA Core Model. Retrieved 7 December, 2015, from http://www.eunethta.eu/hta-core-model
- U.S. Preventive Services Task Force (2015). Final Update Summary: Lipid Disorders in Children: Screening. Retrieved 7 December, 2015, from: http://www.uspreventiveservicestaskforce.org/Page/Document/UpdateSummaryFinal/lipid-disorders-in-children-screening
A2-6.03.1-v1.1


