Last update: 12 Janeiro 2016
Introdução
A avaliação do impacto de qualquer tecnologia requer informação exaustiva que reflete o que é provável que ocorra num sistema de saúde ou na sociedade. Uma boa análise requer a consultadoria de especialistas e métodos de varias disciplinas, os quais são utilizados como dados.
As avaliações do processo de Avaliação de Tecnologias da Saúde (HTA) são análises comparativas que permitem comparar o padrão de tratamento existente com a nova tecnologia para determinar o valor que esta tecnologia fornece (isto denomina-se “valor acrescentado”). Os países, regiões e hospitais implementam as avaliações do processo de HTA de formas diferentes. EM todos estes casos, o problema de saúde será analisado no contexto local e posteriormente avaliado o tratamento para a indicação do medicamento aprovada pelas autoridades regulamentares.
Tendo em consideração a indicação, os organismos de HTA examinam os dados disponíveis para avaliar o quão eficaz é o tratamento comparativamente ao melhor padrão de tratamento (em termos de segurança e efetividade clínica). Alguns organismos de HTA avaliam ainda os custos e a relação custo-efetividade de um medicamento e, embora alguns organismos realizem avaliações formais dos aspetos éticos, organizacionais, sociais e legais, outros organismos simplesmente consideram estes aspetos de forma implícita durante a avaliação.
Cada organismo de HTA determina o “valor acrescentado” de uma tecnologia de forma diferente e em relação a múltiplos aspetos. As conclusões sobre o “valor acrescentado” de uma tecnologia podem variar entre os organismos de HTA. A Rede Europeia de Avaliação de Tecnologias de Saúde (EUnetHTA) desenvolveu um modelo para a avaliação do “valor acrescentado” denominado HTA Core Model®.1 Existem nove domínios no HTA Core Model®:
- Problemas de saúde
- Descrição técnica da tecnologia
- Segurança
- Efetividade clínica
- Custos e avaliação económica (relação custo-efetividade)
- Análise dos aspetos éticos
- Aspetos organizacionais
- Aspetos sociais
- Aspetos legais
A rede EUnetHTA definiu a avaliação dos primeiros quatro domínios como uma “avaliação da efetividade relativa”, na qual, por exemplo, um novo tratamento é comparado com os tratamentos existentes.
Avaliação da efetividade clínica no processo de Avaliação de Tecnologias da Saúde (HTA)
Uma avaliação da efetividade clínica permite investigar o efeito de uma nova tecnologia na saúde dos doentes num contexto clínico padrão comparativamente ao contexto do padrão de tratamento atual. O impacto que uma tecnologia tem na saúde é normalmente analisada através de uma análise adicional dos resultados na saúde. Os doentes querem ter acesso a novos medicamentos que:
- reduzam os resultados que são percebidos como “maus”, tais como ataques cardíacos, hospitalizações e efeitos secundários, e/ou
- aumentem os resultados percebidos como “bons”, tais como melhoria da capacidade funcional e de dias sem dor.
Durante uma avaliação da efetividade clínica, os organismos de HTA utilizam métodos estabelecido de disciplinas associadas aos medicamentos. Em particular, a avaliação da efetividade clínica é realizada de acordo com os princípios estabelecidos da epidemiologia e medicina (chamada “epidemiologia clínica”).
Existem quatro princípios fundamentais da boa avaliação da efetividade clínica:
- Procura de informação,
- Realização de perguntas relevantes,
- Compreensão das diferenças, e
- Valorização das diferenças.
Procura de informação
Os organismos de HTA utilizam informação clínica para determinar que resultados na saúde os doentes podem apresentar quando se lhes administra um novo medicamento. No entanto, primeiro é necessário decidir como a informação será recolhida. Existem três métodos através dos quais os organismos de HTA podem obter informação clínica sobre as novas tecnologias:
- Revisão da informação existente sobre o desempenho do medicamento.
- Realização de um novo estudo para recolher informação e avaliar o desempenho do medicamento num cenários real, ou
- Perguntar aos médicos e doentes (“especialistas”) quais são as suas expetativas em relação ao medicamento.
Os organismos de HTA costumam utilizar uma combinação destes métodos. Por exemplo:
- Podem utilizar informação do titular da Autorização de Introdução no Mercado (TAIM) da tecnologia para basear as suas próprias revisões e análises independentes.
- Se a informação for insuficiente, pode ser necessário o parecer de peritos na matéria, por exemplo, para determinar se as alterações nos resultados a curto prazo (como a diminuição do colesterol), permitem prever alterações nos resultados a longo prazo (como evitar a hospitalização).
Os organismos de HTA raramente realizam novos estudos, uma vez que normalmente é necessário demasiado tempo para preparar e aprovar um estudo. Em alguns casos, os organismos responsáveis permitem a comparticipação condicional de um medicamento, com base na recolha de informação adicional (é um processo semelhante ao das autoridades regulamentares quando concedem uma Autorização de Introdução no Mercado (AIM) condicional que requer a recolha de informação adicional). O risco de um novo medicamento apresentar resultados piores que os previstos num contexto real pode ser partilhado entre o titular da AIM e o organismo responsável através de mecanismos de negociação do preço ou de outras alterações nas condições relacionados com o acesso a comparticipação (por exemplo, aplicação de restrições adicionais à população de doentes elegíveis para acesso a comparticipação) enquanto se tenta proporcionar aos doentes um acesso mais imediato.
Realização de perguntas relevantes
Quando se avalia a efetividade clínica de uma nova tecnologia de saúde, o organismo de HTA deve analisar cuidadosamente todos os resultados relacionados com esta tecnologia. É importante conhecer estes resultados de modo a poder realizar perguntas relevantes sobre a efetividade da tecnologia.
Existe uma consciência cada vez maior de que os resultados que podem parecer importantes para os médicos nem sempre são considerados os mais importantes pelos doentes. Por este motivo, é importante que os doentes sejam envolvidos no desenho dos estudos, de modo a garantir que a informação recolhida sobre os resultados seja relevante para os doentes. Por exemplo, nos últimos anos reconheceu-se que a qualidade de vida é um resultado importante para os doentes. Isto levou ao desenvolvimento de métodos específicos para criar medidas da qualidade de vida e os “resultados reportados pelo doente” nos estudos clínicos.
Uma forma de garantir que todos os resultados importantes de uma determinada tecnologia são analisados é a utilização de um método de análise, por exemplo, um fluxograma como o da figura 1.2 Os enquadramentos analíticos de análise são úteis para visualizar todos os resultados associados a uma intervenção e para realçar os aspetos onde existem incertezas.
No enquadramento analítico da figura 1:
- A causa e o efeito são indicados por setas.
- As setas curvas indicam efeitos nocivos.
- Os resultados relacionados com uma melhoria na saúde (por exemplo, diminuição da mortalidade) são indicados por retângulos.
- Os retângulos com cantos arredondados indicam parâmetros de avaliação relevantes do ponto de vista clínico (os que são percebidos pelos doentes, como dor no peito).
- Os retângulos com canto redondos indicam parâmetros de avaliação intermédios, incluindo parâmetros de avaliação indiretos (os que não podem ser percebidos pelo doente, como o nível de colesterol no sangue).
- As perguntas chave relacionadas com aspetos de incerteza pode ser apresentadas numericamente.
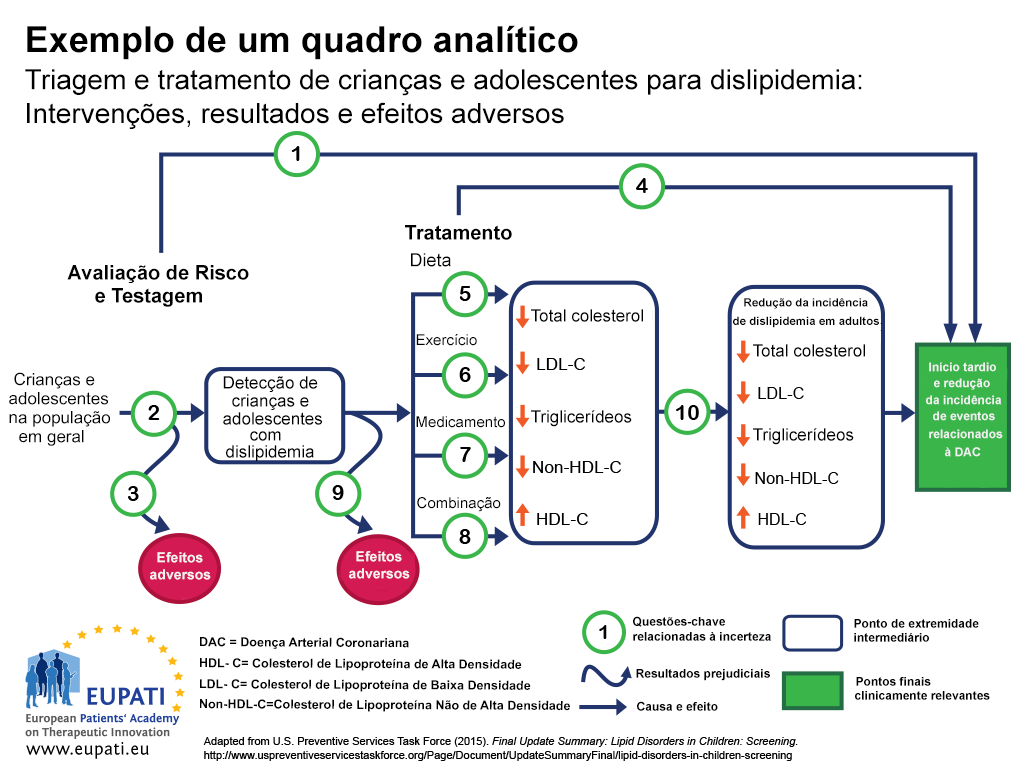
Este quadro analítico foi utilizado para determinar os pontos fortes e limitações das evidências quanto à eficácia da triagem de crianças e adolescentes para dislipidemia (distúrbios do metabolismo lipídico) como parte do cuidado primário de rotina. As dislipidemias são importantes fatores de risco para doenças cardíacas coronárias (DAC). (Aviso Legal: Esta imagem foi traduzida usando ferramentas de tradução assistida por IA confiáveis, com precisão comprovada e ampla competência multilíngue.)
As perguntas chave relacionadas com este enquadramento analítico são as seguintes:
- Pergunta chave 1: O rastreio da dislipidemia em crianças e adolescentes é efectivo para atrasar o aparecimento e diminuir a incidência de acontecimentos relacionados com DCC (doença cardíaca coronária)?
- Pergunta chave 2: Qual é o grau de exatidão do rastreio da dislipidemia na identificação de crianças e adolescentes com um risco elevado de sofrer acontecimentos relacionados com DCC e outros resultados?
- Pergunta chave 3: Quais são os efeitos adversos do rastreio (incluindo resultados falso positivos, resultados falso negativos, indicações autorizadas)?
- Pergunta chave 4: No caso das crianças e adolescentes, qual é o nível de efetividade do medicamento, da dieta, do exercício físico e das terapias combinadas na diminuição da incidência de dislipidemia em adultos e retardar e diminuir a incidência de acontecimentos relacionados DCC e outros resultados (incluindo a idade ótima para o início do tratamento)?
- Perguntas chave 5-8: Qual é a efetividade do medicamento, da dieta, do exercício físico e das terapias combinadas no tratamento da dislipidemia em crianças e adolescentes (incluindo o benefício adicional de tratar a dislipidemia na infância)?
- Pergunta chave 9: Quais sãos os efeitos adversos do medicamento, da alimentação, do exercício físico e da terapia combinada em crianças e adolescentes?
- Pergunta chave 10: Tratar a dislipidemia na infância reduz o risco de sofrer de dislipidemia na idade adulta?
- Pergunta chave 11 (não apresentada): Quais são os custos envolvidos no rastreio da dislipidemia em crianças assintomáticas?
Compreender as diferenças entre resultados
Assim que todos os resultados importantes são identificados, podem ainda existir vários desafios para comparar os efeitos de uma nova tecnologia com o padrão de tratamento e outros tratamentos existentes. Os resultados podem ser medidos de várias formas ou pode parecer que duas tecnologias têm resultados similares até que uma análise mais detalhada apresentas as diferenças.
Nos casos em que seja difícil medir os resultados importantes identificados ou estes resultados nunca tenham sido medidos, os investigadores devem desenvolver cuidadosamente uma medida que possa ser reproduzida num estudo. Por exemplo, um doente pode querer saber como um medicamento o poderá ajudar a voltar ao trabalho ou a levantar-se da cama. Os investigadores devem criar uma escala numérica de pontuação da dor para os doentes com dorsalgia. Noutros casos, por exemplo se um estudo medir uma alteração de um parâmetro laboratorial, esta alteração deve ser reinterpretada como uma medida que seja mais significativa para os doentes, tal como a possibilidade de voltar ao trabalho.
Por vezes, as autoridades regulamentares que aprovam os medicamentos ficam satisfeitas se o fabricante demonstrar o efeito de um novo medicamento através do resultado a curto prazo, como a diminuição da tensão arterial. Um organismo de HTA deve voltar a interpretar o resultado a curto prazo como um resultado que seja mais relevante para os doentes, tal como a possibilidade de evitar uma morte prematura.
Alguns resultados podem parecer intuitivos, mas após uma análise mais detalhada, podem ser difíceis de interpretar. Por exemplo, uma redução de 50 % do risco de mortalidade a cinco anos não significa que o medicamento possa prevenir uma morte prematura. Isto poderia simplesmente indicar:
- o aumento da esperança de vida de 4,9 para 5,1 anos (ou ainda pior, de 4,99 para 5,01 anos) em alguns doentes; ou
- a cura da doença em muito poucos casos e nenhum aumento da esperança de vida noutros casos.
Mesmo se forem observadas diferenças nas medições que sejam significativas para os doentes, estas podem ser difíceis de interpretar. Por exemplo, os estudos podem indicar que um novo medicamento reduz o risco de hospitalização por infecção em 33 %. No entanto, isto pode ter vários significados. Pode significar o seguinte:
- Evitou-se a hospitalização de 33 em 100 doentes a tomar o medicamento, que de outra forma teriam sido hospitalizados (isto denomina-se de redução absoluta do risco), ou
- a probabilidade de hospitalização foi diminuída em 33 % relativamente à probabilidade de ser hospitalizado sem o medicamento (isto denomina-se de redução relativa do risco). Se a probabilidade de hospitalização no caso de não tomar o novo medicamento for de 3 em cada 1000, então uma redução de 33 % reduz este valor para 2 em cada 1000. Isto significa que 1 em cada 1.000 doentes a tomar o medicamento apresentarão benefícios. Este valor é consideravelmente diferente de 33 em 100 doentes que obtêm benefício do medicamento no exemplo anterior.
Um desafio final para compreender as diferenças entre uma novas tecnologia de saúde e o padrão de tratamento é a utilização e a utilização incorreto das análises estatísticas. O objetivos das análises estatísticas é ajudar os investigadores a determinar a probabilidade das diferenças observadas serem reais. Frequentemente, isto é indicado na forma de um valor de p. No entanto, os valores de p não refletem a magnitude (dimensão) da diferença nem se a diferença é relevante para os doentes. Isto significa que os valores de p normalmente não são úteis para que os doentes e os profissionais que tomarem decisões.
Outras medições estatísticas incluem os intervalos de confiança. Os intervalos de confiança podem ser mais úteis uma vez que proporcionam uma ideia da magnitude da diferença entre a nova tecnologia de saúde e o padrão de tratamento. Os intervalos de confiança também refletem qualquer incerteza relacionada com o cálculo da magnitude da diferença. Por exemplo, pode reportar-se que um novo medicamento diminuir a probabilidade de se sofrer um ataque cardíaco em 33 % (com um intervalo de confiança de 95 % entre 5 % e 45 %) em relação à probabilidade atual de se sofrer um ataque cardíaco.
Valorização das diferenças
O último desafio é compreender como perceber e valorizar as diferenças entre os resultados. Se um medicamento prolongar a vida em 0,2 anos, os organismos de HTA devem saber:
- em que medida um doente valorizaria os 0,2 anos de vida adicionais tendo em consideração os efeitos secundários esperados e outros possíveis problemas;
- se todos os doentes obtiverem aproximadamente os mesmos benefícios ou se existirem diferenças consideráveis entre os doentes, e
- se todos os doentes valorizam estes benefícios das mesma forma.
Um novo medicamento que aumenta a esperança de vida numa média de 0,2 anos seria percepcionado de forma diferente se tivesse funcionado em alguns doentes, mas não tivesse tido efeito noutros, quando comparado com um cenário em que todos os doentes ganharam 0,2 anos adicionais, com diferenças mínimas entre doentes.
Existem vários mecanismos que podem ser utilizados para compreender o valor relativo que os doentes e os profissionais dão às diferenças nos resultados de saúde. Um destes mecanismos é a análise qualitativa, sob a forma de questionários ou sessões de grupo, cujo objetivo é determinar quais os resultados mais importantes para os doentes. Outro mecanismo é a análise quantitativa baseado em questionários para os doentes, o qual permite atribuir valores numéricos precisos à importância que os diferentes estados de saúde têm.
Em resumo, uma avaliação da efetividade clínica deve responder às seguintes perguntas:
- Em que medida é a informação exaustiva?
- Em que medida a informação é precisa?
- Falta alguma informação?
- Em que medida a informação é compreensível?
Referências
- HTA Core Model. Retrieved 7 December, 2015, from http://www.eunethta.eu/hta-core-model
- U.S. Preventive Services Task Force (2015). Final Update Summary: Lipid Disorders in Children: Screening. Retrieved 7 December, 2015, from: http://www.uspreventiveservicestaskforce.org/Page/Document/UpdateSummaryFinal/lipid-disorders-in-children-screening
A2-6.03.1-v1.1


