Last update: 12 ianuarie 2016
Introducere
Evaluarea impactului oricărei tehnologii necesită informații cuprinzătoare care reflectă potențialele efecte ale acesteia în cadrul sistemului de sănătate sau al societății. O analiză bună implică utilizarea consultanței experților și metode din diferite discipline, utilizate pentru obținerea datelor.
Evaluările HTA sunt analize comparative, care compară tratamentul standard existent cu noua tehnologie pentru a determina valoarea oferită de aceasta din urmă (așa-numita „valoare adăugată”). Țările, regiunile și spitalele implementează evaluările HTA în moduri diferite. O problemă de sănătate este analizată în contextul local, iar apoi tratamentul este evaluat pentru indicația acceptată de către autoritățile de reglementare pentru medicamentul respectiv.
Având în vedere indicația respectivă, organismele de HTA examinează datele disponibile pentru a determina cât de bine poate funcționa tratamentul în comparație cu tratamentul standard existent (în ceea ce privește siguranța și eficiența clinică). Unele organisme de HTA evaluează, de asemenea, costurile și eficiența economică a unui medicament și, în timp ce unele dintre acestea efectuează evaluări formale ale aspectelor etice, organizaționale, sociale și legale, altele includ aceste aspecte în mod implicit în evaluările lor.
„Valoarea adăugată” a unei tehnologii este determinată de fiecare organizație de HTA într-un mod diferit, care implică mai multe aspecte. Concluziile privind „valoarea adăugată” a unei tehnologii pot varia de la o organizație de HTA la alta. Rețeaua europeană pentru HTA (European network for HTA – EUnetHTA) a dezvoltat un cadrul de lucru pentru evaluarea „valorii adăugate”, numit HTA Core Model®.1 HTA Core Model® include nouă domenii:
- Problema de sănătate
- Descrierea tehnică a tehnologiei
- Siguranța
- Eficiența clinică
- Costurile și evaluarea economică (eficiența costurilor)
- Analiza etică
- Aspectele organizaționale
- Aspectele sociale
- Aspectele legale
EUnetHTA a definit evaluarea primelor patru domenii ca „evaluare a eficienței relative” prin care, de exemplu, un nou tratament este comparat cu tratamentele existente.
Evaluarea eficienței clinice în cadrul HTA
O evaluare a eficienței clinice investighează efectul unei noi tehnologii asupra sănătății pacienților într-un cadru clinic standard, în comparație cu cel al tratamentului standard existent. Impactul unei tehnologii asupra sănătății este, în general, analizat prin examinarea detaliată a rezultatelor legate de sănătate. Pacienții doresc să aibă acces la noi medicamente care:
- reduc rezultatele percepute ca „negative” – cum ar fi infarctul, spitalizarea sau efectele secundare și/sau
- sporesc rezultatele percepute ca „pozitive” – cum ar fi îmbunătățirea capacității de a efectua activități sau zilele lipsite de durere.
În timpul evaluării eficienței clinice, organismele de HTA utilizează metode recunoscute din disciplinele medicale asociate. Evaluarea eficienței clinice se bazează în special pe principii împrumutate din epidemiologie și medicină (respectiv din „epidemiologia clinică”).
Există patru principii de bază ale unei bune evaluări a eficienței clinice:
- Căutarea informațiilor,
- Punerea în discuție a întrebărilor relevante,
- Înțelegerea diferențelor și
- Valorizarea diferențelor.
Căutarea informațiilor
Organismele de HTA utilizează informațiile clinice pentru a estima rezultatele legate de sănătate la care pacienții se pot aștepta atunci când primesc un nou medicament. În primul rând, însă, acestea trebuie să decidă cum vor colecta informațiile. Există trei moduri diferite în care organismele de HTA pot obține informații clinice privind noile tehnologii:
- Analiza informațiilor existente privind performanțele medicamentului,
- Efectuarea unui nou studiu pentru colectarea de informații și evaluarea performanțelor medicamentului într-un cadru real sau
- Solicitarea de informații de la clinicieni și pacienți („experți”) privind așteptările acestora de la medicament.
Organismele de HTA utilizează deseori o combinație a acestor abordări. De exemplu:
- Acestea pot utiliza informații furnizate de titularul autorizației de punere pe piață (TAPP) a tehnologiei pentru a își desfășura propriile evaluări și analize independente.
- Atunci când lipsesc informații, pot fi necesare opinii ale experților – de exemplu, pentru a determina dacă modificările rezultatelor pe termen scurt (cum ar fi reducerea nivelului de colesterol) pot genera predicții privind rezultatele pe termen lung (cum ar fi evitarea spitalizării).
Organismele de HTA comandă rareori studii noi, deoarece timpul necesar pentru organizarea și desfășurarea unui studiu este, în general, prea lung. În anumite cazuri, organismele responsabile au permis compensarea condiționată a unui medicament în funcție de colectarea unor informații suplimentare (în mod similar cu acordarea de către autoritățile de reglementare a unei autorizații de punere pe piață (APP) condiționate de colectarea unor informații suplimentare). Riscul ca un medicament să aibă, în condiții reale de utilizare, performanțe mai reduse decât cele așteptate poate fi împărțit apoi între TAPP și organismul responsabil prin mecanisme de negociere a prețurilor sau alte modificări ale condițiilor asociate cu accesul compensat la medicament (cum ar fi restricții suplimentare privind populația de pacienți care poate beneficia de accesul compensat), cu avantajul că pacienții primesc mai rapid accesul la medicament.
Punerea în discuție a întrebărilor relevante
La evaluarea eficienței clinice a unei noi tehnologii medicale, organismul de HTA trebuie să acorde atenția necesară tuturor rezultatelor asociate tehnologiei respective. Este important ca aceste rezultate să fie cunoscute pentru ca întrebările relevante privind eficiența tehnologiei să poată fi puse în discuție.
Înțelegem din ce în ce mai bine faptul că rezultatele care pot părea importante pentru clinicieni nu sunt întotdeauna considerate cele mai importante de către pacienți. De aceea, este important ca pacienții să fie implicați în conceperea studiilor, pentru a se asigura furnizarea informațiilor privind rezultatele importante pentru aceștia. De exemplu, în ultimii ani, se recunoaște faptul că un rezultat important pentru pacienți este calitatea vieții. Acest lucru a condus la dezvoltarea unor metodologii speciale pentru crearea unor instrumente de măsurare a calității vieții și a așa-numitelor „rezultate raportate de pacienți” în cadrul studiilor clinice.
Una dintre abordările posibile care au drept scop examinarea tuturor rezultatelor importante ale unei anumite tehnologii constă în utilizarea unui cadru analitic – de exemplu a unei diagrame de proces similare cu cea din figura 1.2 Cadrele analitice sunt utile pentru vizualizarea tuturor rezultatelor asociate unei intervenții și pentru evidențierea oricăror incertitudini.
În cadrul analitic din figura 1:
- Cauzele și efectele sunt reprezentate prin săgeți.
- Săgețile curbate indică rezultate negative.
- Rezultatele constând în îmbunătățiri ale sănătății (de exemplu, reducerea mortalității) sunt reprezentate prin dreptunghiuri.
- Dreptunghiurile cu colțuri ascuțite indică punctele finale relevante din punct de vedere clinic (cele percepute de pacient, cum ar fi durerea toracică).
- Dreptunghiurile cu colțuri rotunjite reprezintă punctele finale intermediare, inclusiv punctele finale surogat (care nu pot fi percepute de către pacient, cum ar fi nivelul colesterolului din sânge).
- Întrebările-cheie privind incertitudinea vor putea fi apoi reprezentate numeric.
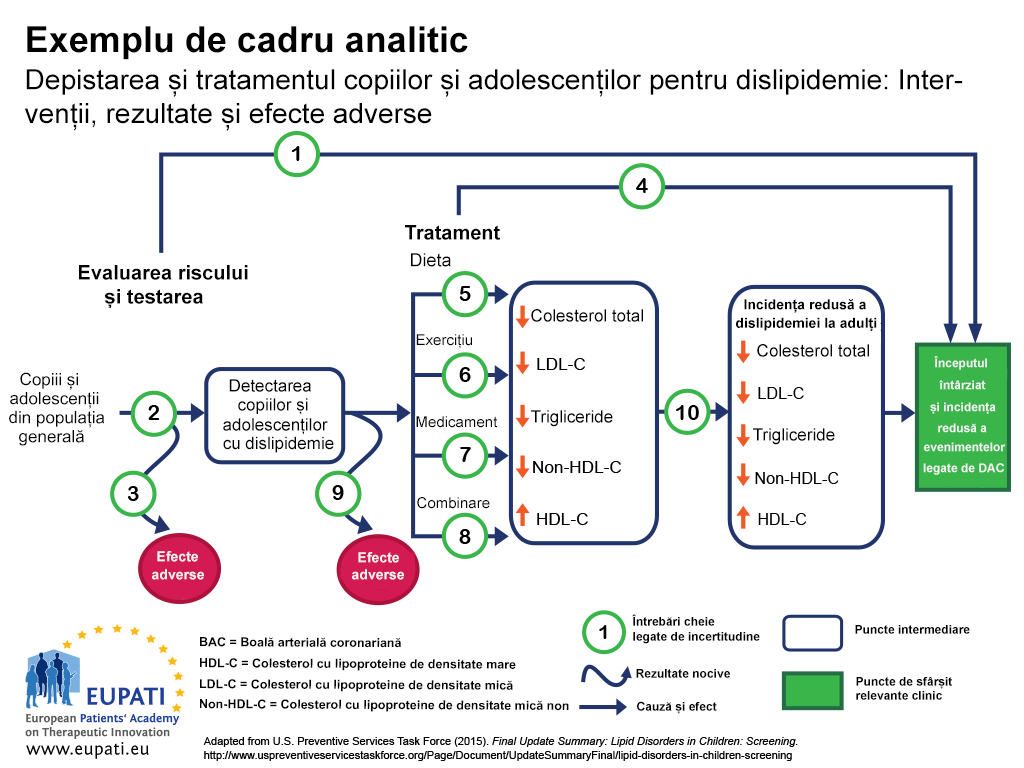
Acest cadru analitic a fost folosit pentru a determina punctele forte și limitările dovezilor privind eficacitatea screeningului copiilor și adolescenților pentru dislipidemie (tulburări ale metabolismului lipidic) ca parte a îngrijirii primare de rutină. Dislipidemiile sunt factori de risc importanți pentru boala coronariană (CHD). (Declarație de neasumare a răspunderii: Această imagine a fost tradusă folosind unelte de traducere asistată de IA fiabile, cu o acuratețe dovedită și o competență multilingvă largă.)
În acest cadru analitic, întrebările-cheie sunt următoarele:
- Întrebarea-cheie 1: Examinarea pentru detectarea dislipidemiei la copii/adolescenți este eficientă pentru întârzierea apariției și reducerea incidenței evenimentelor asociate cu CI (cardiopatia ischemică)?
- Întrebarea-cheie 2: Care este nivelul de precizie al examinării pentru detectarea dislipidemiei în ceea ce privește copiii/adolescenții cu risc crescut de evenimente asociate cu CI și alte rezultate?
- Întrebarea-cheie 3: Care sunt evenimentele adverse ale examinării (inclusiv rezultatele fals pozitive, rezultatele fals negative sau etichetarea)?
- Întrebarea-cheie 4: La copii și adolescenți, care este eficiența medicamentelor, dietei, activității fizice și a terapiei combinate pentru reducerea incidenței dislipidemiei la adulți și pentru întârzierea apariției și reducerea incidenței evenimentelor asociate cu CI și alte rezultate (inclusiv vârsta optimă pentru inițierea tratamentului)?
- Întrebările-cheie 5–8: Care este eficiența medicamentelor, dietei, activității fizice și a terapiei combinate pentru tratarea dislipidemiei la copii/adolescenți (inclusiv beneficiul incremental al tratării dislipidemiei în copilărie)?
- Întrebarea-cheie 9: Care sunt efectele adverse ale medicamentelor, dietei, activității fizice și terapiei combinate la copii/adolescenți?
- Întrebarea-cheie 10: Îmbunătățirea dislipidemiei în copilărie reduce riscul de dislipidemie la vârsta adultă?
- Întrebarea-cheie 11 (nu este inclusă în imagine): Care sunt problemele legate de costurile examinărilor pentru detectarea dislipidemiei la copiii asimptomatici?
Înțelegerea diferențelor între rezultate
După identificarea tuturor rezultatelor importante, pot exista în continuare provocări legate de compararea efectelor unei tehnologii noi cu tratamentul standard existent și alte terapii existente. Rezultatele pot fi măsurate în mai multe moduri sau două tehnologii pot părea să aibă rezultate similare până ce o verificare mai atentă detectează diferențe.
În cazurile în care rezultatele importante identificate sunt dificil de măsurat sau nu au mai fost măsurate anterior, cercetătorii trebuie să creeze cu atenție un instrument de măsură care să poată fi apoi reprodus în cadrul unui studiu. De exemplu, un pacient poate dori să știe cum îl va ajuta un medicament să își reia munca sau viața activă. Cercetătorii pot crea o scară numerică de evaluare a durerii pentru pacienții cu dureri lombare. În alte cazuri, de exemplu atunci când un studiu măsoară modificările unui parametru de laborator, aceste modificări trebuie reinterpretate printr-un instrument de măsură mai relevant pentru pacienți, cum ar fi posibilitatea reluării activității profesionale.
Uneori, autoritățile de reglementare care aprobă medicamentele pot fi satisfăcute dacă producătorul unui medicament demonstrează efectele unui nou medicament pe baza rezultatelor pe termen scurt, cum ar fi reducerea tensiunii arteriale. Un organism de HTA va trebui să reinterpreteze rezultatul pe termen scurt sub forma unui rezultat mai relevant pentru pacienți, cum ar fi evitarea decesului prematur.
Unele rezultate pot părea intuitive, însă, la o examinare mai atentă, pot fi dificil de interpretat. De exemplu, o reducere a riscului de mortalitate pe o perioadă de cinci ani (deces în interval de cinci ani) cu 50% nu înseamnă că medicamentul poate preveni decesul prematur. Rezultatul poate consta în:
- prelungirea speranței de viață de la 4,9 la 5,1 ani (sau, chiar mai rău, de la 4,99 la 5,01 ani) la anumiți pacienți sau
- vindecarea bolii în cazul câtorva pacienți fără ca speranța de viață a celorlalți să fie prelungită.
Chiar dacă se observă diferențe grație instrumentelor de măsură relevante pentru pacienți, acestea pot fi, la rândul lor, dificil de interpretat. De exemplu, studiile pot indica reducerea de către un medicament nou al riscului de spitalizare în caz de infecție cu 33%. Acest lucru poate însemna, însă, mai multe lucruri. Acesta poate însemna că:
- 33 din 100 de persoane care iau medicamentul și care ar fi fost altfel spitalizate au evitat spitalizarea (ceea ce poartă numele de reducere absolută a riscului) sau
- probabilitatea spitalizării este redusă cu 33% în raport cu probabilitatea spitalizării în absența medicamentului (ceea ce poartă numele de reducere relativă a riscului). Dacă probabilitatea spitalizării în absența noului medicament este de 3 la 1000, atunci o reducere cu 33% va scădea această proporție la 2 din 1000. Acest lucru înseamnă că 1 din fiecare 1000 de persoane care iau medicamentul va obține acest beneficiu. Este un rezultat diferit de exemplul de mai sus, în care 33 din 100 de persoane obțin acest beneficiu.
O provocare finală legată de înțelegerea diferențelor dintre o nouă tehnologie medicală și tratamentul standard existent constă în utilizarea, corectă sau eronată, a testelor statistice. Testele statistice au rolul de a îi ajuta pe cercetători să afle dacă diferențele detectate prezintă probabilitatea de a fi reale. Deseori, acest lucru este raportat sub forma valorii p. Valoarea p nu reflectă, însă, magnitudinea (dimensiunea) diferenței și nu indică dacă diferența respectivă este sau nu semnificativă pentru pacienți. Acest lucru înseamnă că valoarea p nu este, în general, utilă pentru pacienți și furnizorii de servicii medicale atunci când aceștia trebuie să ia decizii.
Printre alte instrumente statistice de măsură se numără intervalele de încredere. Intervalele de încredere sunt mai utile, deoarece oferă o imagine a magnitudinii diferenței între noua tehnologie medicală și tratamentul standard existent. Intervalele de încredere reflectă, de asemenea, orice incertitudine privind estimarea magnitudinii diferenței. De exemplu, se poate raporta reducerea cu 33% de către un medicament nou a probabilității unui infarct viitor (cu un interval de încredere la 95% de 5 până la 45%) în raport cu probabilitatea curentă a unui infarct.
Valorizarea diferențelor
Ultima provocare ține de înțelegerea modului de percepere și valorizare a diferențelor între rezultate. Dacă un medicament prelungește viața cu 0,2 ani, organismele de HTA trebuie să știe:
- cât de mult valorizează pacienții prelungirea vieții cu 0,2 ani, date fiind efectele secundare preconizate și alte aspecte,
- dacă toți pacienții primesc aproximativ aceleași beneficii sau dacă există diferențe considerabile între pacienți și
- dacă toți pacienții valorizează aceste beneficii în mod similar.
Un nou medicament care prelungește, în medie, speranța de viață cu 0,2 ani ar fi perceput diferit dacă ar funcționa la anumiți pacienți fără a avea niciun efect la alții, în comparație cu un scenariu în care toți pacienții ar obține 0,2 ani, cu diferențe mici între pacienți.
Există mai multe mecanisme care pot fi utilizate pentru înțelegerea valorii relative acordate de pacienți și furnizorii de servicii medicale diferențelor între rezultatele legate de sănătate. Unul dintre acestea este cercetarea calitativă, prin chestionare sau grupuri tematice, pentru determinarea rezultatelor care sunt cele mai importante pentru pacienți. Un altul este cercetarea cantitativă bazată pe chestionare în rândul pacienților, prin care se alocă valori numerice precise importanței acordate diferitelor stări de sănătate.
Pe scurt, o evaluare a eficienței clinice trebuie să răspundă la următoarele întrebări:
- Cât de cuprinzătoare au fost informațiile?
- Cât de exacte sunt informațiile?
- Lipsește ceva?
- Cât de inteligibile sunt informațiile?
Referințe
- HTA Core Model. Retrieved 7 December, 2015, from http://www.eunethta.eu/hta-core-model
- U.S. Preventive Services Task Force (2015). Final Update Summary: Lipid Disorders in Children: Screening. Retrieved 7 December, 2015, from: http://www.uspreventiveservicestaskforce.org/Page/Document/UpdateSummaryFinal/lipid-disorders-in-children-screening
A2-6.03.1-v1.1


