Last update: 12 enero 2016
Introducción
La evaluación de la repercusión de cualquier tecnología requiere información exhaustiva que refleje qué es probable que suceda en un sistema sanitario o en la sociedad. Un análisis óptimo requiere el asesoramiento de expertos y métodos de varias disciplinas, los cuales se usan como datos.
Las evaluaciones del proceso de evaluación de tecnologías sanitarias (HTA, por sus siglas en inglés) son análisis comparativos que permiten comparar el tratamiento de referencia existente con la nueva tecnología para determinar qué valor aporta dicha tecnología (esto se denomina «valor añadido»). Los países, las regiones y los hospitales implementan los procesos de HTA de distintas formas. En todos estos casos, el problema sanitario se analiza en el contexto local y posteriormente se evalúa el tratamiento para la indicación del medicamento aprobada por las autoridades de registro sanitario.
Teniendo en cuenta la indicación, los organismos de HTA examinan los datos disponibles para evaluar qué tan eficaz es el tratamiento en comparación con el mejor tratamiento de referencia (en aspectos como la seguridad y la eficacia clínica real). Algunos organismos de HTA evalúan además los costes y la rentabilidad de un medicamento y, aunque algunos organismos realizan evaluaciones formales de los asuntos éticos, organizativos, sociales y legales, otros organismos simplemente consideran estos asuntos de forma implícita durante la evaluación.
Cada organismo de HTA determina el «valor añadido» de una tecnología de forma distinta y en relación con múltiples facetas. Las conclusiones sobre el «valor añadido» de una tecnología pueden variar entre los organismos de HTA. La Red Europea de Evaluación de Tecnologías Sanitarias (EUnetHTA, por sus siglas en inglés) ha desarrollado un modelo para la evaluación del «valor añadido» llamado HTA Core Model®.1 El modelo HTA Core Model® incluye nueve áreas:
- Problema sanitario
- Descripción técnica de la tecnología
- Seguridad
- Eficacia clínica real
- Costes y evaluación económica (rentabilidad)
- Análisis de los asuntos éticos
- Asuntos organizativos
- Asuntos sociales
- Asuntos legales
La red EUnetHTA define la evaluación de las primeras cuatro áreas como una «evaluación de la eficacia real relativa» (por ejemplo, comparación de un tratamiento nuevo con los tratamientos existentes).
Evaluación de la eficacia clínica real para el proceso de HTA
La evaluación de la eficacia clínica real permite investigar el efecto de una tecnología nueva en la salud de los pacientes en un contexto clínico de referencia que se compara con el contexto del tratamiento de referencia vigente. La repercusión de una tecnología sanitaria se suele analizar mediante un análisis adicional de los efectos en la salud. Los pacientes desean tener acceso a medicamentos nuevos que:
- reduzcan los efectos percibidos como «perjudiciales» (por ejemplo, infartos de miocardio, hospitalizaciones y efectos secundarios);
- aumenten los efectos percibidos como «beneficiosos» (por ejemplo, aumento de la capacidad funcional y días sin dolor).
Durante la evaluación de la eficacia clínica real, los organismos de HTA usan métodos establecidos de disciplinas asociadas al ámbito de la farmacología. De manera especial, la evaluación de la eficacia clínica real se realiza de acuerdo con los principios de los campos de la epidemiología y la medicina (esto se llama «epidemiología clínica»).
La evaluación óptima de la eficacia clínica real se basa en cuatro principios fundamentales:
- Búsqueda de información
- Planteamiento de preguntas relevantes
- Comprensión de las diferencias
- Valoración de las diferencias
Búsqueda de información
Los organismos de HTA usan información clínica para determinar qué efectos en la salud pueden experimentar los pacientes cuando se les administra un medicamento nuevo. No obstante, primero es necesario decidir cómo se va a recopilar la información. Hay tres métodos mediante los cuales los organismos de HTA pueden obtener información clínica sobre las nuevas tecnologías:
- Revisión de la información existente sobre el desempeño del medicamento.
- Realización de un estudio nuevo para recopilar información y evaluar el desempeño del medicamento en un entorno real.
- Consulta a médicos y pacientes («expertos») sobre cuáles son sus expectativas en relación con el medicamento.
Los organismos de HTA suelen usar una combinación de estos métodos. Por ejemplo:
- Pueden usar información del titular de la autorización de comercialización de la tecnología en la que basar sus propias revisiones y análisis independientes.
- Si la información es insuficiente, puede ser necesario el dictamen de expertos en la materia (por ejemplo, para determinar si las variaciones de los resultados a corto plazo, como la reducción del colesterol, permiten predecir las variaciones de los resultados a largo plazo, como la posibilidad de evitar la hospitalización).
Los organismos de HTA no suelen encargar nuevos estudios, ya que normalmente se requiere demasiado tiempo para preparar y aprobar un estudio. En determinados casos, los organismos responsables permiten el reembolso de un medicamento de forma condicional de acuerdo con la información adicional recopilada (se trata de un proceso similar al de las autoridades de registro sanitario que conceden una autorización de comercialización condicional que requiere la recopilación de información adicional). El riesgo de que un medicamento nuevo ofrezca resultados peores a los previstos en un contexto real puede ser compartido por el titular de la autorización de comercialización y el organismo responsable mediante mecanismos de negociación del precio u otros cambios en las condiciones relacionados con el reembolso (por ejemplo, aplicación de restricciones adicionales a la población de pacientes aptos para el acceso con reembolso) mientras se intenta ofrecer a los pacientes un acceso más inmediato.
Planteamiento de preguntas relevantes
A la hora de evaluar la eficacia clínica real de una tecnología sanitaria nueva, el organismo de HTA debe examinar detenidamente todos los resultados relacionados con dicha tecnología. Es importante conocer estos resultados para poder plantear preguntas pertinentes sobre la eficacia real de la tecnología.
Hay una conciencia cada vez mayor de que los resultados que pueden parecer importantes para los médicos no siempre son considerados los más importantes por parte de los pacientes. Por este motivo, es importante que los pacientes participen en el diseño de los estudios con el fin de garantizar que la información recopilada sobre los resultados sea relevante para ellos. Por ejemplo, en los últimos años se ha reconocido que la calidad de vida es un aspecto importante para los pacientes. Esto ha dado lugar al desarrollo de métodos específicos para generar mediciones de la calidad de vida y los «resultados percibidos por el paciente» en los estudios clínicos.
Una forma de garantizar el examen de todos los resultados importantes de una tecnología determinada es el uso de un método de análisis (por ejemplo, el que se muestra en el diagrama de flujo de la figura 1.2. Los métodos de análisis son útiles para visualizar todos los resultados relacionados con una intervención y para destacar los aspectos dudosos.
En el caso del método de análisis de la figura 1:
- La causa y el efecto se indican con flechas.
- Las flechas curvas indican efectos perjudiciales.
- Los resultados relacionados con una mejora sanitaria (por ejemplo, disminución de la mortalidad) se indican con rectángulos.
- Los rectángulos con esquinas no redondeadas indican criterios de valoración relevantes desde el punto de vista clínico (aquellos percibidos por el pacientes, como el dolor de pecho).
- Los rectángulos con esquinas redondeadas indican criterios intermedios de valoración, lo que incluye criterios indirectos de valoración (los cuales no pueden ser percibidos por el paciente, como en el caso del nivel de colesterol).
- Las preguntas clave relacionadas con aspectos dudosos se indican con números.
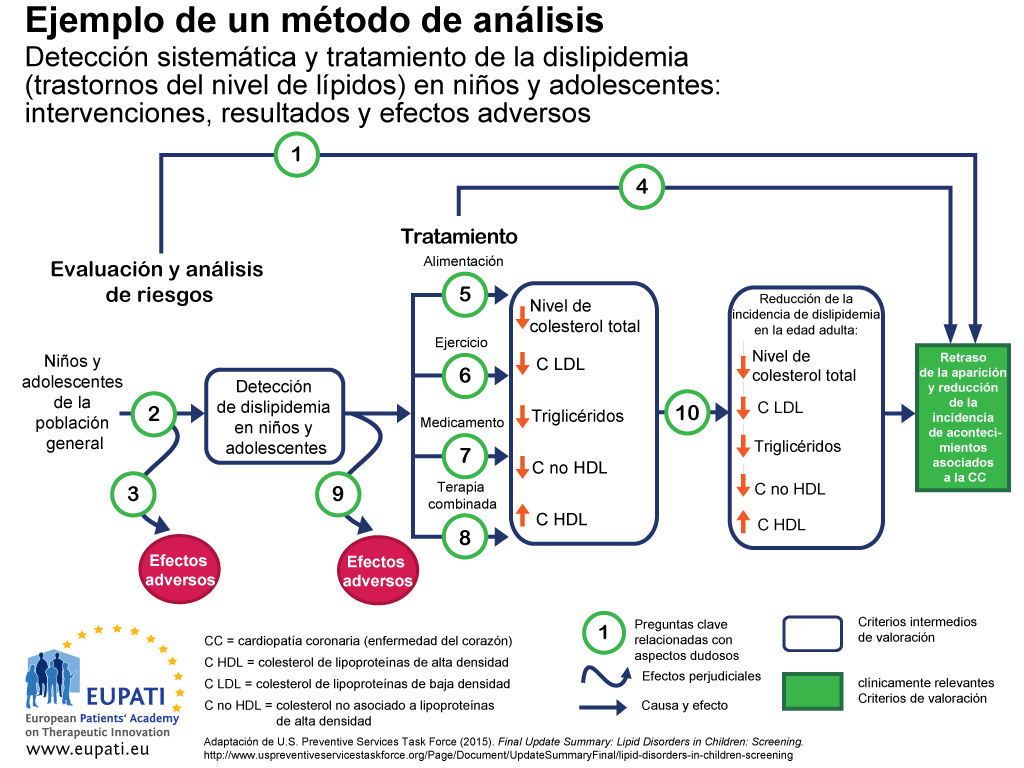
Este marco analítico se utilizó para determinar las fortalezas y limitaciones de la evidencia sobre la eficacia del cribado de niños y adolescentes para la dislipidemia (trastornos del metabolismo de los lípidos) como parte de la atención primaria de rutina. Las dislipidemias son factores de riesgo importantes para la enfermedad coronaria (CHD).
Las preguntas clave relacionadas con este método de análisis son las siguientes:
- Pregunta clave 1: ¿Es la detección sistemática de la dislipidemia (niveles alterados de grasas en sangre) en niños y adolescentes eficaz para retrasar la aparición y reducir la incidencia de acontecimientos relacionados con enfermedades del corazón?
- Pregunta clave 2: ¿Cuál es el grado de precisión de la detección sistemática de la dislipidemia en niños y adolescentes con un alto riesgo de padecer acontecimientos relacionados con enfermedades del corazón y otros efectos?
- Pregunta clave 3: ¿Cuáles son los efectos adversos de la detección sistemática (incluidos los resultados positivos falsos, los resultados negativos falsos o las indicaciones autorizadas)?
- Pregunta clave 4: En el caso de los niños y adolescentes, ¿cuál es el nivel de eficacia real del fármaco, la alimentación, el ejercicio físico y las terapias combinadas para reducir la incidencia de dislipidemia en la edad adulta y retrasar y reducir la incidencia de acontecimientos relacionados con enfermedades del corazón y otros efectos (incluida la edad óptima para el inicio del tratamiento)?
- Preguntas clave 5-8: ¿Cuál es el nivel de eficacia real del fármaco, la alimentación, el ejercicio físico y la terapia combinada para tratar la dislipidemia en niños y adolescentes (incluido el beneficio acumulado del tratamiento de la dislipidemia en la infancia)?
- Pregunta clave 9: ¿Cuáles son los efectos adversos del fármaco, la alimentación, el ejercicio físico y la terapia combinada en niños y adolescentes?
- Pregunta clave 10: ¿Reduce el control de la dislipidemia en la infancia el riesgo de padecer dislipidemia en la edad adulta?
- Pregunta clave 11 (no mostrada): ¿Cuáles son los costes derivados de la detección sistemática de la dislipidemia en niños asintomáticos?
Comprensión de las diferencias entre resultados
Una vez que se identifican los resultados importantes, aún puede existir una serie de obstáculos para comparar los efectos de una tecnología nueva con el tratamiento de referencia y otros tratamientos existentes. Los resultados se pueden medir de varias formas o bien puede parecer que dos tecnologías ofrecen resultados similares hasta que un análisis más detallado demuestra las diferencias.
En los casos en los que sea difícil medir los resultados importantes identificados o dichos resultados no se hayan medido nunca, los investigadores deben desarrollar detenidamente un método de medición que se pueda reproducir en un estudio. Por ejemplo, es posible que un paciente desee saber cómo un medicamento le puede ayudar a reiniciar su actividad laboral o a levantarse de la cama. Los investigadores deben crear una escala numérica de puntuación del dolor para los pacientes con el dolor de espalda baja (lumbalgia). En otros casos, por ejemplo si un estudio se usa para medir un cambio de un parámetro de laboratorio, este cambio se debe reinterpretar como una medida que sea más significativa para los pacientes, tal como la posibilidad de volver al trabajo.
En ocasiones, las autoridades responsables de la autorización de medicamentos están satisfechas si el fabricante demuestra el efecto de un medicamento nuevo mediante el resultado a corto plazo, como la disminución de la presión sanguínea. Un organismo de HTA debe volver a interpretar el resultado a corto plazo como un resultado que sea más relevante para los pacientes, tal como la posibilidad de evitar una muerte prematura.
Algunos resultados pueden parecer intuitivos, pero tras un examen más detenido, pueden ser difíciles de interpretar. Por ejemplo, un 50 % de reducción del riesgo de mortalidad en cinco años no significa que el medicamento pueda prevenir una muerte prematura. Esto podría indicar simplemente:
- el aumento de la esperanza de vida de 4,9 a 5,1 años (o peor aún, de 4,99 a 5,01 años) en algunos pacientes;
- la cura de la enfermedad en muy pocos casos y ningún aumento de la esperanza de vida en otros casos.
Incluso si se observan diferencias en las mediciones que son significativas para los pacientes, estas pueden ser difíciles de interpretar. Por ejemplo, los estudios pueden indicar que un medicamento nuevo redujo el riesgo de hospitalización por infección un 33 %. No obstante, esto puede tener diversos significados. Puede significar lo siguiente:
- Se evitó la hospitalización de 33 de 100 pacientes tratados con el medicamento (esto se llama reducción absoluta del riesgo).
- La probabilidad de hospitalización se redujo un 33 % en relación con la probabilidad de ser ingresado sin el medicamento (esto se llama reducción relativa del riesgo). Si la probabilidad de ser hospitalizado en caso de no tomar el nuevo medicamento se corresponde con 3 de cada 1000, una reducción del 33 % reduce este valor a 2 de cada 1000. Esto significa que 1 de cada 1000 pacientes se beneficiarán del medicamento. Esta cifra varía considerablemente con la de 33 de 100 pacientes que obtienen beneficio del medicamento en el ejemplo anterior.
Un obstáculo final para comprender las diferencias entre una tecnología sanitaria nueva y el tratamiento de referencia es el uso y el uso incorrecto de los análisis estadísticos. La finalidad de los análisis estadísticos es ayudar a los investigadores a determinar si es probable que las diferencias observadas sean reales. A menudo, esto se indica como un valor de p. No obstante, los valores de p no reflejan la magnitud (dimensiones) de la diferencia o si dicha diferencia es relevante para los pacientes. Esto significa que los valores de p normalmente no son de utilidad para los pacientes y los profesionales que toman decisiones.
Otras mediciones estadísticas son los intervalos de confianza. Los intervalos de confianza pueden ser más útiles, ya que ofrecen una idea de la magnitud de la diferencia entre la nueva tecnología sanitaria y el tratamiento de referencia. Además, los intervalos de confianza reflejan cualquier duda relacionada con el cálculo de la magnitud de la diferencia. Por ejemplo, se puede determinar que un medicamento nuevo reduce la probabilidad de padecer un infarto de miocardio un 33 % (con un intervalo de confianza del 95 % entre el 5 % y el 45 %) en relación con la probabilidad actual de padecer un infarto de miocardio.
Valoración de las diferencias
El último obstáculo es comprender cómo percibir y valorar las diferencias entre los resultados. Si un medicamento prolonga la vida 0,2 años, los organismos de HTA deben saber:
- en qué medida un paciente valoraría los 0,2 años de vida adicionales teniendo en cuenta los efectos secundarios previstos y otros posibles problemas;
- si todos los pacientes obtienen aproximadamente los mismos beneficios o si hay diferencias considerables entre los pacientes;
- si todos los pacientes valoran los beneficios de forma similar.
Un medicamento nuevo que aumenta la esperanza de vida una media de 0,2 años se podría percibir de un modo distinto si tiene este efecto en algunos pacientes, pero no en otros, al compararlo con un caso en el que todos los pacientes vivan 0,2 años más, con diferencias mínimas entre ellos.
Hay varios métodos que se pueden usar para comprender el valor relativo que los pacientes y los profesionales conceden a las diferencias en resultados de salud. Uno de estos métodos es el análisis cualitativo, en forma de encuestas o sesiones de grupo, cuyo objetivo es determinar qué resultados son más importantes para los pacientes. Otro método es el análisis cuantitativo basado en encuestas para los pacientes, el cual permite asignar valores numéricos precisos a la importancia que tienen los distintos estados de salud.
En resumen, una evaluación de la eficacia clínica real debe responder a las siguientes preguntas:
- ¿En qué medida es la información exhaustiva?
- ¿En qué medida es la información precisa?
- ¿Falta información?
- ¿En qué medida es la información comprensible?
Referencias
- HTA Core Model. Retrieved 7 December, 2015, from http://www.eunethta.eu/hta-core-model
- U.S. Preventive Services Task Force (2015). Final Update Summary: Lipid Disorders in Children: Screening. Retrieved 7 December, 2015, from: http://www.uspreventiveservicestaskforce.org/Page/Document/UpdateSummaryFinal/lipid-disorders-in-children-screening
A2-6.03.1-v1.1


