Last update: 19 listopada 2015
Wprowadzenie
Niemal każdy lek niesie ze sobą jakiś poziom ryzyka. W większości wypadków jest ono znikome, ale każde zidentyfikowane ryzyko (takie jak możliwe zdarzenia niepożądane, interakcje) jest wymienione na ulotce dołączanej do opakowania. Władze ds. zdrowia publicznego i podmioty odpowiedzialne posiadające pozwolenie na dopuszczenie do obrotu są zobowiązane do monitorowania i udoskonalania wszystkich stosowanych leków. Częścią tego zobowiązania jest „informowanie o ryzyku”.
Co to jest informowanie o ryzyku?
Informowanie o ryzyku można zdefiniować jako otwartą dwustronną wymianę informacji i opinii o szkodach i korzyściach, której celem jest lepsze zrozumienie ryzyka i podejmowanie lepszych decyzji o stosowaniu leków. Informowanie o ryzyku powinno zatem obejmować:
- Prawdopodobieństwo wystąpienia ryzyka
- Znaczenie opisywanych zdarzeń niepożądanych
- Wpływ takich zdarzeń na pacjenta.
Podczas rozwoju leku, zarządzanie ryzykiem musi być przedstawione w Planie Zarządzania Ryzykiem, który obejmuje zarówno minimalizację zagrożeń, jak i informowanie o potencjalnym ryzyku.
Podstawą rejestracji leku jest fakt, że w momencie rejestracji stosunek korzyści do ryzyka został uznany za korzystny w docelowej populacji dla określonych wskazań. Jednak w momencie rejestracji nie wszystkie rzeczywiste i potencjalne zagrożenia będą zidentyfikowane. Ponadto, skuteczność w badaniach klinicznych może nie odzwierciedlać rzeczywistej skuteczności leku w powszechnej praktyce medycznej. Stosunek korzyści do ryzyka danego leku oceniony w momencie rejestracji niewątpliwie zmieni się po dopuszczeniu leku do obrotu.
Dlatego zarówno władze ds. zdrowia publicznego, jak podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu są zobowiązani do wdrożenia systemu umożliwiającego:
- Identyfikację i analizę zagrożeń
- Przeprowadzenie oceny korzyści
- Ponowną ocenę i charakterystykę oceny stosunku korzyści do ryzyka
- Wdrożenie działań minimalizujących ryzyko w celu ochrony zdrowia publicznego
- Informowanie o ryzyku
Minimalizowanie ryzyka
Pacjenci i pracownicy służby zdrowia mają dostęp do kilku źródeł kontrolowanych i wystandaryzowanych formatów informacji o lekach i związanym z nimi ryzyku. Są to ulotka dołączana do opakowania i Charakterystyka produktu leczniczego (ChPL).
Oprócz ulotki dołączanej do opakowania i Charakterystyki produktu leczniczego istnieją inne elementy, które mogą pomóc w zarządzaniu zagrożeniem stosowania leków w niekontrolowany sposób, na przykład:
- Wielkość opakowania Małe opakowania mogą być pomocne w kontrolowaniu ryzyka, szczególnie jeśli przedawkowanie jest uważane za poważne zagrożenie.
- Kategoria dostępności leku Kontrolowanie warunków udostępniania leku może zmniejszyć ryzyko związane z jego stosowaniem lub nieprawidłowym stosowaniem. Można to osiągnąć, nadzorując warunki przepisywania leku lub warunki sprzedaży leku bez recepty (inaczej OTC — ang. over-the-counter).
Proces i czas informowania o ryzyku
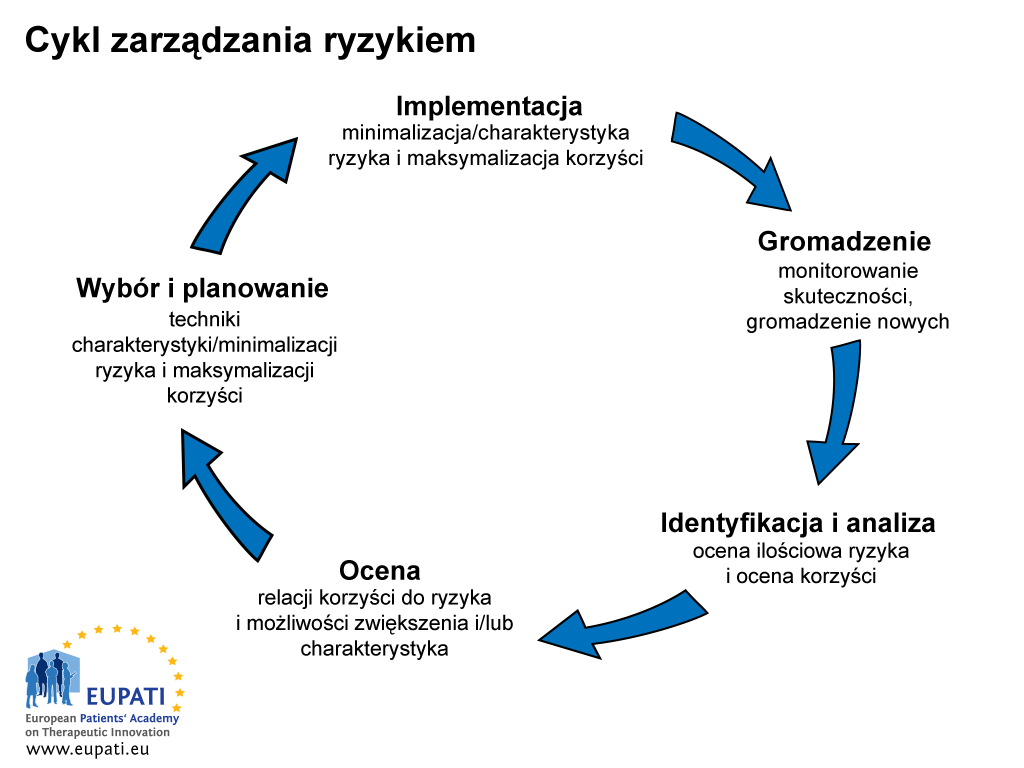
Proces zarządzania ryzykiem i informowania o nim jest pięciostopniowy (zob. Rys. 1).
- Cykl zarządzania ryzykiem składa się z pięciu etapów.
Proces zarządzania ryzykiem i informowania o nim zaczyna się w fazie gromadzenia danych od początkowego alarmu dotyczącego „podejrzanej sytuacji”. Podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu odpowiada za ciągłe monitorowanie zagrożeń związanych ze swoimi lekami zgodnie z odpowiednimi przepisami prawa. Jest także zobowiązany do zgłaszania wyników właściwym władzom.
Podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu odpowiada także za podejmowanie odpowiednich działań mających na celu minimalizację zagrożeń związanych z lekiem i maksymalizację korzyści. Obejmuje to zapewnienie dokładności wszystkich informacji firmy o swoich lekach, aktualizowanie tych informacji i szybkie przekazywanie nowych danych, kiedy tylko staną się dostępne.
Kolejny etap procesu informowania o ryzyku to identyfikacja i analiza ryzyka i jego relacji do korzyści. Wymaga to czasu i oznacza, że istnieje okres niepewności, który wymaga „ostrożnych decyzji”. Celem kolejnego etapu jest ocena i ujęcie ilościowe zagrożeń i korzyści. Następny etap to wybór planu minimalizacji ryzyka i maksymalizacji korzyści. Ostatnim etapem jest implementacja planu.
Ważne jest, aby w ciągu całego procesu informowania przekazywać terminowo jasne i spójne komunikaty. Należy postępować zgodnie z zasadami informowania o bezpieczeństwie/ryzyku. Zasady te obejmują:
- Właściwą koordynację i współpracę pomiędzy różnymi zaangażowanymi stronami
- Komunikaty powinny być istotne, jasne, dokładne i spójne; powinny docierać do właściwych odbiorców w odpowiednim czasie pozwalającym na podjęcie działania
- Informacje powinny być dostosowane do właściwych odbiorców za pomocą odpowiedniego języka
- Informacje o ryzyku powinny być przedstawiane w kontekście korzyści leków i powinny zawierać dostępne i istotne informacje o działaniach niepożądanych
- Należy odnieść się do wszelkich niejasności w kwestiach bezpieczeństwa
- Jeśli jest to właściwe, należy uwzględnić informacje o ryzykach konkurujących
- Do opisywania i porównywania rodzajów ryzyka należy stosować odpowiednie wskaźniki ilościowe
- Po rozwiązaniu problemów bezpieczeństwa powinien zostać opublikowany komunikat zawierający informacje uzupełniające
- Należy ocenić skuteczność procesu informowania
Informowanie o ryzyku niesie ze sobą wyzwania. Takie przeszkody jak słabe umiejętności liczenia, nieprecyzyjny język i sposób prezentacji ryzyka mogą wpływać na przyswajanie informacji.
Jednym z największych wyzwań związanych z informowaniem o ryzyku jest świadomość zdrowotna. Zarówno pacjenci, jak i pracownicy służby zdrowia mogą mieć trudności z interpretowaniem, wykorzystaniem i/lub zapamiętaniem informacji o ryzyku, szczególnie w aspektach statystycznych.
W przypadku pacjentów większość leków jest przepisywana przez lekarzy i dostarczana przez farmaceutów. Zarządzanie korzyściami i ryzykiem przez pacjentów obejmuje przede wszystkim:
- Przestrzeganie harmonogramów i zaleceń dotyczących leczenia
- Świadomość ważnych zagrożeń i działań, które należy podjąć
- Zgłaszanie wszelkich nieprzewidzianych efektów lekarzowi, farmaceucie i krajowym odnośnym władzom
Jednak zależnie od kraju istnieją leki, które można kupować bezpośrednio, bez wskazań ze strony pracowników służby zdrowia (leki dostępne bez recepty, OTC). Pacjenci muszą znać potencjalne korzyści i ryzyko stosowania tych produktów, oraz środki, jakich potrzebują, aby stosować leki bezpiecznie i skutecznie.
Uwzględnianie pacjentów w procesie informowania o ryzyku
Rola pacjentów w procesie informowania o ryzyku jest bardzo ważna. Mogą uczestniczyć w nim różnymi sposobami:
- Mogą gromadzić informacje o bezpieczeństwie na podstawie własnych doświadczeń z lekami — jest to bardzo ważne, ponieważ pacjenci bezpośrednio doświadczają działania leku
- Mogą być konsultantami podczas prac nad komunikatami o bezpieczeństwie i ryzyku, a także wstępnie testować takie komunikaty, aby zapewnić, że są odpowiednie, jasne i zrozumiałe
- Mogą włączać się w opracowywanie wielu dokumentów udostępnianych publicznie — na przykład streszczeń Europejskich Publicznych Sprawozdań Oceniających (ang. European Public Assessment Report, EPAR), ulotek do opakowań i informacji o bezpieczeństwie.
- Mogą odbywać regularne rozmowy z różnymi stronami zainteresowanymi
- Mogą przekazywać i publikować informacje o ryzyku w mediach (media społecznościowe, informacje prasowe itd.)
Inne materiały
- Edwards, A. (2004) ‘Flexible rather than standardised approaches to communicating risks in health care’. British Medical Journal Quality & Safety, 13(3): 169-170. Pobrano 11 września 2015 r. ze strony http://qualitysafety.bmj.com/content/13/3/169.full.pdf+html
- Pfizer Inc. (2011). Understanding risk. Pobrano 11 września 2015 r. ze strony https://web.archive.org/web/20140202170937/http://www.pfizer.com/files/health/medicine_safety/1-2_Understanding_Risk.pdf
A2-5.27-v1.1