Last update: 19 november 2015
Introduktion
Næsten alle lægemidler er forbundet med en eller anden form for risiko. I de fleste tilfælde kan risikoen være ubetydelig, men alle identificerede risici (f.eks. mulige bivirkninger eller interaktioner) er anført på indlægssedlen. Sundhedsmyndigheder og indehavere af markedsføringstilladelser (MAH – Marketing Authorisation Holders) er forpligtede til at overvåge og forbedre alle lægemidler, der er i brug. ‘Risikokommunikation’ er en del af denne forpligtelse.
Hvad er risikokommunikation?
Risikokommunikation kan defineres som en åben tovejsudveksling af information og meninger om skader og fordele med det formål at øge forståelsen af risikoen og forbedre beslutninger om brugen af lægemidler. Risikokommunikation bør derfor dække:
- Sandsynligheden for, at den hændelse, der er risiko for, indtræffer
- Vigtigheden af den uønskede hændelse, der beskrives
- Hændelsens indvirkning på patienten.
Under udviklingen af et lægemiddel skal risikostyring beskrives i en Risikostyringsplan (RMP – Risk Management Plan), som omfatter både minimering af og kommunikation om mulige risici.
Tilladelsen til markedsføring af et lægemiddel er baseret på, at benefit/risk-forholdet på tidspunktet for tilladelsen er vurderet som positivt hos målpopulationen for de angivne indikationer. Men ikke alle aktuelle og potentielle risici er identificeret på det tidspunkt, hvor den første tilladelse gives. Desuden er det ikke sikkert, at virkningen i klinisk forsøgsregi afspejler medicinens effektivitet ved almindelig brug. Benefit/risk-forholdet for et lægemiddel, som det vurderes på tidspunktet for tilladelsen, vil nødvendigvis ændre sig, når lægemidlet bliver godkendt til brug.
Det er derfor et fælles ansvar for sundhedsmyndighederne og indehaveren af markedsføringstilladelsen at have et system klar, som giver mulighed for:
- Identificering og analyse af risici
- Udførelse af vurderingen af fordele
- Reevaluering og karakterisering af vurderingen af benefit/risk-forholdet
- Implementering af aktiviteter, der minimerer risikoen, for at beskytte folkesundheden
- Kommunikation af risikoen
Minimering af risikoen
Patienter og sundhedspersonale har adgang til flere kilder i kontrollerede og standardiserede formater med oplysninger om lægemidler og de risici, de medfører. Det er indlægssedler og produktresuméer.
Ud over indlægssedlen og produktresuméet er der andre elementer, som kan være med til at styre risikoen ved brug af lægemidler på en ukontrolleret måde, f.eks.:
- Pakningens størrelse En lille pakkestørrelse kan være nyttig i begrænsningen af risikoen, især hvis der menes at være en stor risiko for overdosering.
- Udleveringsbestemmelserne for lægemidlet Begrænsning af de måder, et lægemiddel må gøres tilgængeligt på, kan reducere de risici, der er forbundet med brug eller misbrug. Det kan ske ved at sætte betingelser for, hvornår et lægemiddel må ordineres, eller for, hvornår en patient må få et lægemiddel uden recept (også kaldet håndkøbsmedicin).
Proces og tidsplan for risikokommunikation
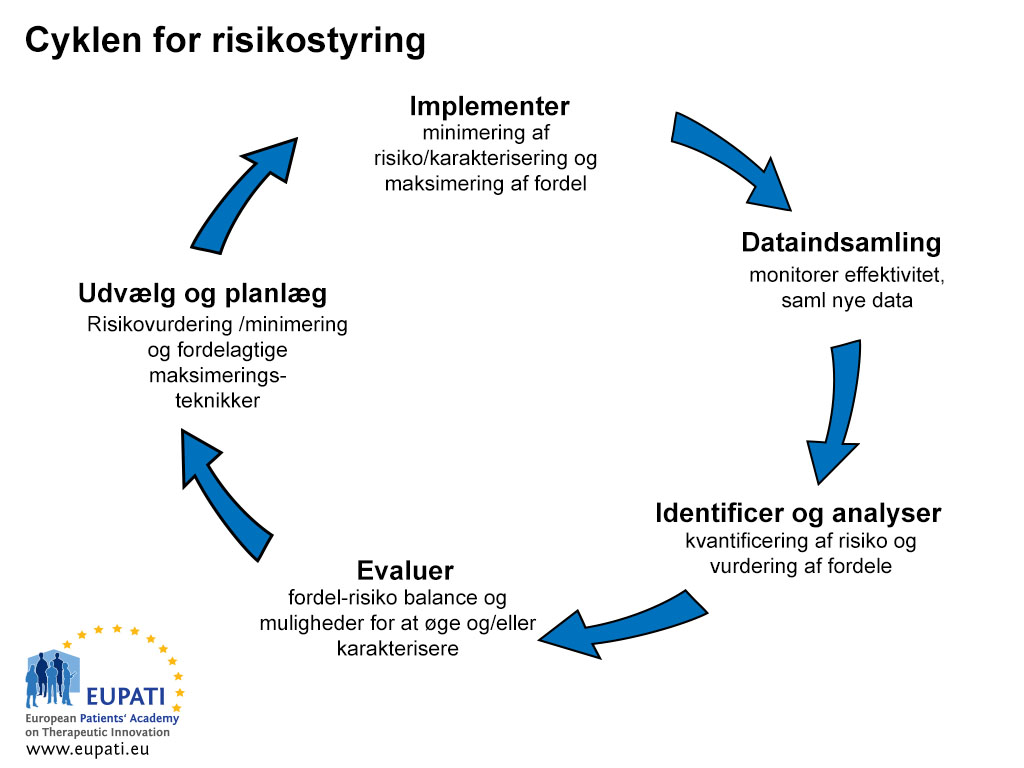
Processen for risikostyring og -kommunikation har fem trin (se figur 1).
- Der er fem trin i risikohåndterings-cyklus
Processen for risikostyring og -kommunikation starter i dataindsamlingsfasen med en første advarsel om en ‘mistænkelig situation’. Indehaverne af markedsføringstilladelsen for et lægemiddel har ansvaret for at sikre konstant overvågning af risiciene ved lægemidlet i henhold til relevant lovgivning. Derefter har de pligt til at rapportere resultaterne til de relevante kompetente myndigheder.
Indehaveren af markedsføringstilladelsen har også ansvaret for at træffe alle relevante foranstaltninger til minimering af de risici, der er forbundet med lægemidlet, og til maksimering af fordelene. Dette indbefatter at sikre, at al information, der udarbejdes af virksomheden vedrørende dens lægemidler, er nøjagtig, samt aktivt at opdatere og straks videregive ny information, når den bliver tilgængelig.
Andet stadium i risikokommunikationsprocessen er at identificere og analysere risikoen og vurdere den i forhold til fordelene. Dette tager noget tid, og det betyder, at der er en periode med uvished, hvor der kræves ‘foreløbige beslutninger’. Næste fase er at evaluere og kvantificere risici og fordele. Dette følges af valget af en plan for minimering af risici og maksimering af fordele. Det sidste stadium er implementering af planen.
Gennem hele kommunikationsprocessen er det vigtigt, at der rettidigt gives klare og konsistente meddelelser. Principperne for sikkerheds-/risikokommunikation skal anvendes. Disse principper omfatter:
- Tilstrækkelig koordinering og samarbejde mellem de forskellige involverede parter
- Meddelelser skal være relevante, klare, præcise og konsistente og nå ud til de rigtige målgrupper på det rigtige tidspunkt, så de kan nå at handle
- Kommunikation skal tilpasses den relevante målgruppe ved hjælp af passende sprogbrug
- Risikokommunikation skal præsenteres i sammenhæng med lægemidlernes fordele og bør omfatte tilgængelig og relevant information om bivirkninger
- Eventuel uvished med hensyn til sikkerhedsproblemet bør også berøres
- Information om konkurrerende risici skal også medtages, når det er relevant
- De mest relevante kvantitative mål skal bruges ved beskrivelse og sammenligning af risici
- Opfølgende kommunikation med supplerende oplysninger skal udsendes, når sikkerhedsproblemet er løst
- Kommunikationens effektivitet skal evalueres
Der er udfordringer ved risikokommunikation. Barrierer såsom dårlig talanvendelse, upræcis sprogbrug og opstillingen (hvordan risikoen præsenteres) kan påvirke opfattelsen af informationen.
Sundhedsforståelse er en af de største udfordringer ved risikokommunikation. Både patienter og sundhedspersonale kan have svært ved at tolke, indarbejde og/eller huske risikoinformation, især når det gælder statistik.
For patienternes vedkommende ordineres størstedelen af lægemidlerne af læger og udleveres af apoteket. Patienternes styring af fordele og risici omfatter især:
- Overholdelse af behandlingsplaner og -anbefalinger
- At være opmærksom på vigtige risici, og hvad der skal gøres
- Rapportering af eventuelle bivirkninger til lægen, apoteket og den nationale kompetente myndighed
Afhængigt af landet er der dog nogle lægemidler, som kan købes direkte uden vejledning fra sundhedspersonale (håndkøbsmedicin). Patienterne må forstå de potentielle fordele og risici ved disse produkter, og hvilke forholdsregler de skal tage for at bruge lægemidlerne sikkert og effektivt.
Patientinvolvering i risikokommunikation
Patienternes rolle i risikokommunikation er meget vigtig. De kan deltage på forskellige måder:
- Ved at indsamle sikkerhedsinformation om deres erfaring med lægemidler – dette er vigtigt, da de er direkte påvirket
- Ved at blive rådspurgt ved udarbejdelsen af sikkerheds- eller risikomeddelelser og ved test af sådanne meddelelser for at sikre, at de er relevante, præcise og forståelige
- Ved at være involveret i udviklingen af en række dokumenter, der offentliggøres – f.eks. EPAR-sammendrag (europæisk offentlig vurderingsrapport), indlægssedler og sikkerhedsmeddelelser
- Ved at være i regelmæssig dialog med de forskellige interessenter
- Gennem input og udbredelse af risikomeddelelser i medierne (sociale medier, pressemeddelelser mv.)
Flere ressourcer
- Edwards, A. (2004) ‘Flexible rather than standardised approaches to communicating risks in health care’. British Medical Journal Quality & Safety, 13(3): 169-170. Retrieved 11 September, 2015, from http://qualitysafety.bmj.com/content/13/3/169.full.pdf+html
- Pfizer Inc. (2011). Understanding risk. Retrieved 11 September, 2015, from https://web.archive.org/web/20140202170937/http://www.pfizer.com/files/health/medicine_safety/1-2_Understanding_Risk.pdf
A2-5.27-v1.1