Last update: 19 November 2015
Einleitung
Nahezu alle Arzneimittel tragen gewisse Risiken in sich. In der Mehrzahl der Fälle kann dieses Risiko vernachlässigbar sein, jedoch werden sämtliche identifizierten Risiken (wie potenzielle Nebenwirkungen und/oder Wechselwirkungen) in der Verpackungsbeilage aufgeführt. Gesundheitsbehörden und Inhaber von Marktzulassungen (Marketing Authorisation Holders, MAHs) sind verpflichtet, sämtliche in Verwendung befindlichen Arzneimittel zu überwachen und zu verbessern. „Risikokommunikation“ ist ein Bestandteil dieser Verpflichtung.
Was ist Risikokommunikation?
Risikokommunikation kann als offener, bidirektionaler Austausch von Informationen und Ansichten zu Schad- und Nutzwirkungen definiert werden, der das Ziel verfolgt, das Verständnis des Risikos zu verbessern und zu fundierteren Entscheidungen hinsichtlich der Anwendung von Arzneimitteln zu gelangen. Risikokommunikation sollte daher die folgenden Aspekte umfassen:
- Wahrscheinlichkeit für das Eintreffen des Risikos
- Die Bedeutung des beschriebenen unerwünschten Ereignisses
- Die Auswirkungen des Ereignisses auf den Patienten
Während der Entwicklung eines Arzneimittels muss das Risikomanagement im Rahmen eines Risikomanagementplans (RMP) Berücksichtigung finden; dieser umfasst sowohl die Minimierung als auch die Kommunikation potenzieller Risiken.
Die Zulassung eines Arzneimittels erfolgt auf Grundlage der Tatsache, dass zum Zeitpunkt der Zulassung die Nutzen-Risiko-Beurteilung für die Anwendung des Arzneimittels für die Behandlung der spezifizierten Indikation(en) bei der Zielpopulation spricht. Zum Zeitpunkt der erstmaligen Marktzulassung sind jedoch nicht sämtliche tatsächlichen oder potenziellen Risiken bereits identifiziert. Zudem muss die im Rahmen einer klinischen Studie ermittelte Wirkung nicht notwendigerweise der tatsächlichen Wirkung des Arzneimittels im medizinischen Alltag entsprechen. Das zum Zeitpunkt der Marktzulassung beurteilte Nutzen-Risiko-Verhältnis eines Arzneimittels unterliegt nach der Erteilung der Marktzulassung unvermeidlicherweise gewissen Veränderungen.
Gesundheitsbehörden und Inhaber von Marktzulassungen (Marketing Authorisation Holders, MAHs) stehen daher gemeinsam in der Pflicht, ein System für die Bewältigung der folgenden Aufgaben zu etablieren und zu unterhalten:
- Identifizierung und Analyse von Risiken
- Durchführung der Nutzen-Beurteilung
- Re-Evaluierung und Charakterisierung der Nutzen-Risiko-Beurteilung
- Implementierung von Aktivitäten zur Minimierung des Risikos im Interesse des Schutzes der Volksgesundheit
- Kommunikation des Risikos
Minimieren des Risikos
Patienten und Angehörige des Gesundheitswesens können auf kontrollierte und im Format standardisierte Informationen zu Arzneimitteln und ihren Risiken zugreifen. Bei diesen handelt es sich um die Packungsbeilagen (Package Leaflets, PL) und die Zusammenfassung der Produktmerkmale (Summary of Product Characteristics, SmPC), auch „Fachinformation“ genannt.
Neben der PL und der SmPC können weitere Aspekte dazu beitragen, das Risiko bei einer unkontrollierten Verwendung von Arzneimitteln in Grenzen zu halten. Dies sind beispielsweise:
- Die Packungsgröße Eine kleine Packungsgröße kann dazu beitragen, das Risiko in Grenzen zu halten, speziell dann, wenn Überdosierung als schwerwiegendes Risiko angesehen wird.
- Der Verschreibungsstatus des Arzneimittels Die Kontrolle der Art und Weise, in der ein Arzneimittel verfügbar gemacht wird, kann die mit seinem Gebrauch oder Missbrauch assoziierten Risiken reduzieren. Dies kann durch Festlegung der Modalitäten für die Verordnung (BtM-rezeptpflichtig, rezeptpflichtig, rezeptfrei) bzw. den Vertriebsweg (apothekenpflichtig oder nicht) eines Arzneimittels erreicht werden.
Der Prozess und der zeitliche Rahmen der Risikokommunikation
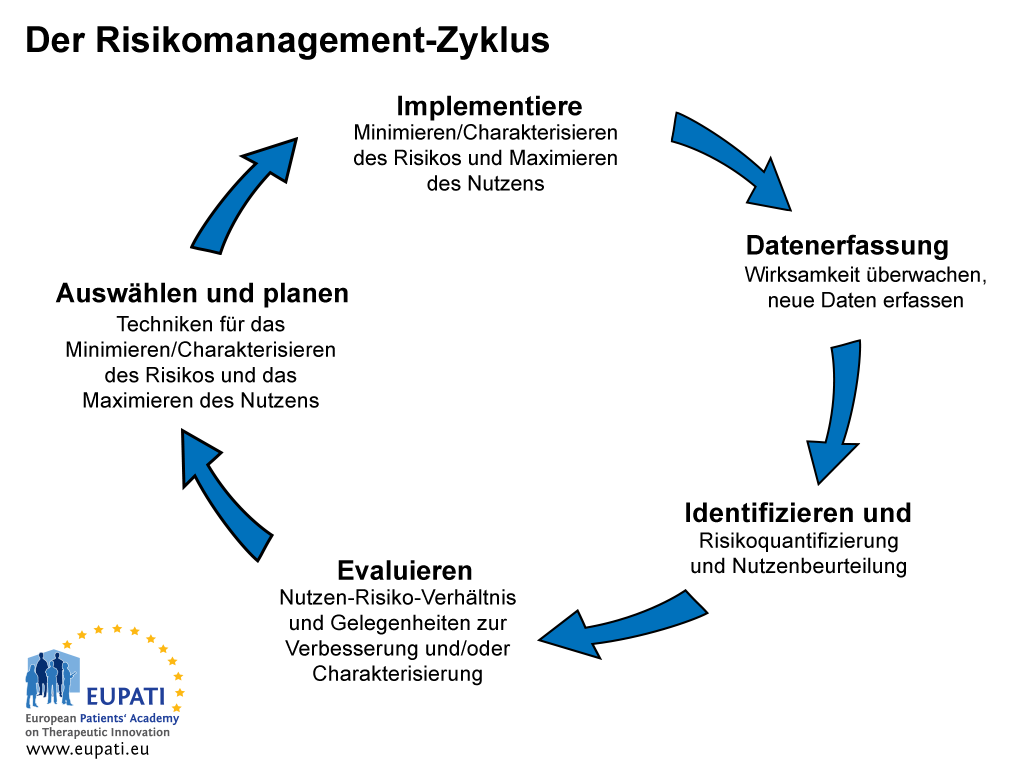
Der Prozess des Risikomanagements und der Risikokommunikation umfasst fünf Schritte (siehe Abbildung 1).
- Der Risikomanagement-Zyklus umfasst fünf Schritte.
Der Prozess des Risikomanagements und der Risikokommunikation beginnt während der Datenerfassungsphase mit einer initialen „Alarmierung über eine verdächtige Situation“. Der Inhaber der Marktzulassung für ein Arzneimittel muss eine kontinuierliche, den Bestimmungen der einschlägigen Gesetzgebung entsprechende Überwachung der Risiken des Arzneimittels sicherstellen. Zudem ist er verpflichtet, die Ergebnisse dieser Überwachung den zuständigen Behörden zur Kenntnis zu bringen.
Der Inhaber der Marktzulassung muss zudem alle zumutbaren Maßnahmen ergreifen, die geeignet sind, die Risiken des Arzneimittels zu minimieren und seinen Nutzen zu maximieren. Dies umfasst die Sicherstellung der Genauigkeit sämtlicher vom Unternehmen zu seinen Arzneimitteln herausgegebenen Informationen sowie die aktive Aktualisierung und zeitnahe Kommunikation neuer Informationen, sobald diese verfügbar werden.
Der zweite Schritt des Risikokommunikations-Prozesses besteht aus dem Identifizieren und Analysieren der Risiken und deren Beurteilung im Kontext des Nutzens. Dies nimmt eine gewisse Zeit in Anspruch, was bedeutet, dass eine gewisse Periode der Unsicherheit besteht, die „vorsorgliche Entscheidungen“ erfordert. Der nächste Schritt besteht aus dem Evaluieren und Quantifizieren der Risiken und Nutzen. Dem schließt sich die Auswahl eines Plans für die Minimierung der Risiken und die Maximierung des Nutzens an. Der letzte Schritt schließlich ist die Implementierung des Plans.
In allen Phasen des Kommunikationsprozesses ist es von größter Bedeutung, zeitnah eindeutige und konsistente Mitteilungen zu machen. Die Prinzipien der Sicherheits-/Risikokommunikation sollten Anwendung finden. Zu diesen Prinzipien gehören:
- Adäquate Koordination und Kooperation zwischen den verschiedenen beteiligten Parteien
- Mitteilungen sollten relevant, eindeutig, genau und konsistent sein und die jeweilige Zielgruppe zum richtigen Handlungszeitpunkt erreichen.
- Die Kommunikation sollte durch Anwendung geeigneter Sprache auf die jeweilige Zielgruppe zugeschnitten werden.
- Risikokommunikation sollte im Kontext des Nutzens des Arzneimittels dargestellt werden und verfügbare relevante Informationen zu Nebenwirkungen enthalten.
- Etwaige Unsicherheiten im Zusammenhang mit Sicherheitsbedenken sollten ebenfalls angesprochen werden.
- Sofern angebracht sollten Informationen zu konkurrierenden Risiken eingeschlossen werden.
- Für die Beschreibung und den Vergleich von Risiken sollten die am besten geeigneten quantitativen Maße genutzt werden.
- Nach Behebung eines sicherheitsrelevanten Problems sollte eine Nachfolge-Kommunikation mit ergänzenden Informationen herausgegeben werden.
- Die Effektivität der Kommunikation sollte evaluiert werden.
Die Risikokommunikation stellt die Beteiligten vor gewisse Herausforderungen. Barrieren wie schlechte Rechenkenntnisse, ungenaue Formulierungen und die gewählte Form der Darstellung können die Wahrnehmung der Information beeinträchtigen.
Gesundheitskompetenz stellt eine der größten Herausforderungen der Risikokommunikation dar. Patienten wie auch Angehörige des Gesundheitswesens können Probleme mit der Interpretation, der Einbeziehung und/oder dem Einprägen von Risikoinformationen (insbesondere ihrer statistischen Aspekte) haben.
Aus Patientensicht wird das Gros der Arzneimittel vom Arzt verordnet und vom Apotheker ausgegeben. Die Möglichkeiten des Patienten, auf Nutzen und Risiken Einfluss zu nehmen, umfassen in der Hauptsache Folgendes:
- Einhaltung der Behandlungspläne und -empfehlungen
- Kenntnis der relevanten Risiken und der gegebenenfalls zu ergreifenden Maßnahmen
- Meldung sämtlicher unerwünschter Wirkungen an den Arzt, Apotheker und die zuständige Gesundheitsbehörde
Je nach Land gibt es jedoch bestimmte Arzneimittel, die ohne jede Beratung durch einen Angehörigen des Gesundheitswesens erworben werden können (rezeptfreie, nicht apothekenpflichtige Arzneimittel). Patienten müssen die möglichen Nutzen und Risiken dieser Produkte kennen und wissen, welche Maßnahmen sie für die sichere und wirksame Anwendung dieser Arzneimittel zu ergreifen haben.
Beteiligung der Patienten an der Risikokommunikation
Patienten spielen bei der Risikokommunikation eine äußerst bedeutende Rolle. Sie können sich auf verschiedene Weise beteiligen:
- Durch Erfassung von Sicherheitsinformationen zu ihrer Erfahrung mit Arzneimitteln – dies ist von Bedeutung, da sie direkt betroffen sind
- Durch Einbeziehung bei der Formulierung von Sicherheits- oder Risikomitteilungen oder dem Vorabtest derartiger Mitteilungen, mit dem sichergestellt wird, dass diese relevant, klar und verständlich sind
- Durch Einbeziehung bei der Entwicklung diverser öffentlich verfügbar gemachter Dokumente wie den Zusammenfassungen des „Europäischen Öffentlichen Beurteilungsberichts“ (EPAR), Packungsbeilagen und Sicherheitshinweisen
- Durch regelmäßigen Dialog mit den verschiedenen Interessengruppen
- Durch Einbringung und Verbreitung der Risikokommunikation in Medien (soziale Medien, Pressemitteilungen usw.)
Weitergehende Informationen
- Edwards A. (2004) Flexible rather than standardised approaches to communicating risks in health care. British Medical Journal Quality & Safety, 13(3): 169-170. (Stand: 11. September 2015) http://qualitysafety.bmj.com/content/13/3/169.full.pdf+html
- Pfizer Inc. (2011). Understanding risk. (Stand: 11. September 2015) https://web.archive.org/web/20140202170937/http://www.pfizer.com/files/health/medicine_safety/1-2_Understanding_Risk.pdf
A2-5.27-v1.1