Last update: 19 november 2015
Inleiding
Bij vrijwel alle geneesmiddelen is sprake van enig risico. In de meeste gevallen is dit risico wellicht verwaarloosbaar, maar alle vastgestelde risico’s (zoals potentiële bijwerkingen, interacties) worden vermeld in de bijsluiter. Gezondheidsautoriteiten en handelsvergunninghouders zijn verplicht alle geneesmiddelen die worden gebruikt, te monitoren en verbeteren. ‘Risicocommunicatie’ is een onderdeel van deze verplichting.
Wat is risicocommunicatie?
Risicocommunicatie kan worden gedefinieerd als een open, wederzijdse uitwisseling van informatie en meningen over schadelijke effecten en voordelen, met als doel meer inzicht te verkrijgen in de risico’s en voor verbetering van besluiten over het gebruik van geneesmiddelen. Risicocommunicatie moet daarom het volgende omvatten:
- de kans dat het risico optreedt;
- het belang dat de bijwerking wordt beschreven;
- het effect van de bijwerking op de patiënt.
Tijdens de ontwikkeling van een geneesmiddel moet het risicomanagement worden beschreven in een risicomanagementplan (RMP); dit omvat zowel de minimalisering van potentiële risico’s als de bespreking ervan.
Een geneesmiddel wordt goedgekeurd op grond van het feit dat de baten-risicobalans, op het moment van goedkeuring, als gunstig beoordeeld is voor de doelpopulatie voor de gespecificeerde indicatie(s). Niet alle feitelijke of potentiële risico’s zullen echter zijn vastgesteld op het moment dat een eerste goedkeuring wordt verleend. Bovendien geeft de werkzaamheid binnen de setting van een klinisch onderzoek mogelijk niet de werkelijke effectiviteit weer van het geneesmiddel in de dagelijkse medische praktijk. De baten-risicobalans van een geneesmiddel zoals beoordeeld op het moment van goedkeuring zal onvermijdelijk veranderen nadat het geneesmiddel voor gebruik is goedgekeurd.
Het is daarom de gezamenlijke verantwoordelijkheid van de gezondheidsautoriteiten en de handelsvergunninghouder dat er een systeem bestaat dat het volgende mogelijk maakt:
- identificatie en analyse van risico’s;
- beoordeling van het voordeel;
- herbeoordeling en karakterisering van de baten-risicobeoordeling;
- implementatie van activiteiten die het risico minimaliseren voor bescherming van de volksgezondheid;
- communicatie over het risico;
minimalisering van het risico.
Patiënten en zorgprofessionals hebben toegang tot diverse bronnen van gecontroleerde en gestandaardiseerde soorten informatie over de geneesmiddelen en hun risico’s. Dit zijn de bijsluiters en de samenvatting van de productkenmerken.
Naast de bijsluiter en samenvatting van de productkenmerken kunnen andere elementen helpen het risico van het gebruik van geneesmiddelen op een ongecontroleerde manier aan te pakken, bijvoorbeeld:
- de verpakkingsgrootte.
Een kleine verpakkingsgrootte kan zinvol zijn om het risico onder controle te houden, in het bijzonder als overdosering als een ernstig risico wordt gezien; - de wettelijke status van het geneesmiddel;
controle van de omstandigheden waaronder een geneesmiddel beschikbaar kan komen, kan de risico’s gerelateerd aan het gebruik of misbruik ervan terugdringen. Dit kan worden bereikt door de omstandigheden te controleren waaronder een geneesmiddel kan worden voorgeschreven of waaronder een patiënt een geneesmiddel kan verkrijgen zonder recept (ook vrij verkrijgbaar genoemd);
het proces en de timing van risicocommunicatie;
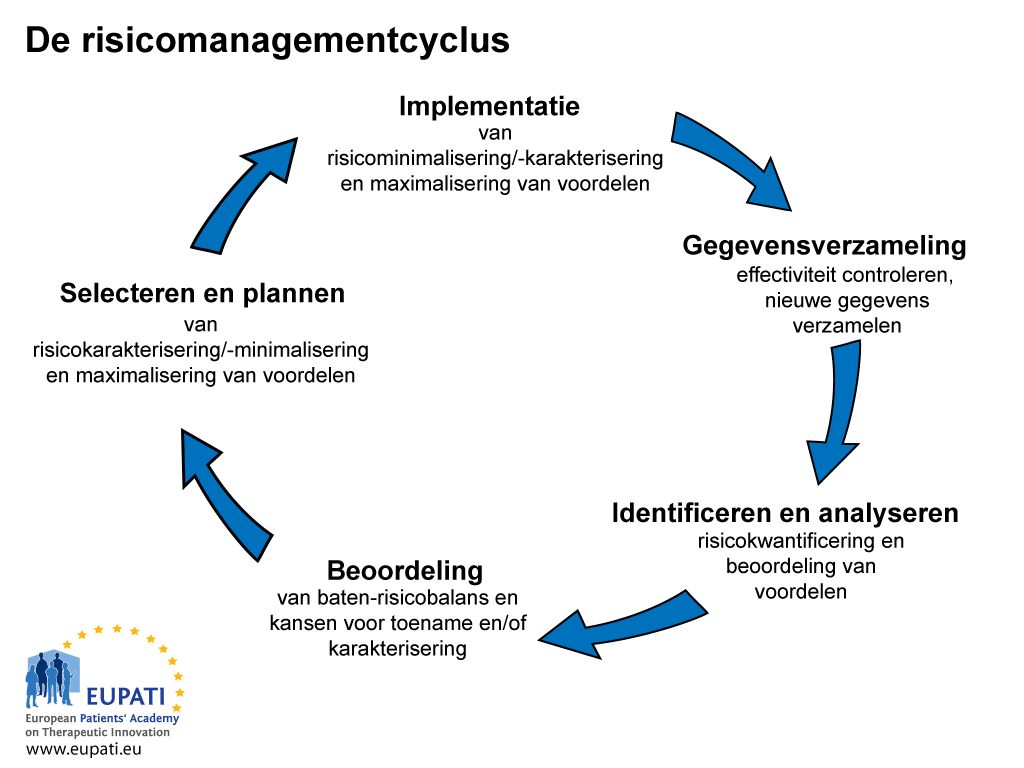
het proces van risicomanagement en communicatie is een proces dat vijf stappen omvat (zie afbeelding 1).
- De risicomanagementcyclus omvat vijf stappen.
Het risicomanagement en het communicatieproces beginnen tijdens de fase van gegevensverzameling met een eerste alarmsignaal van een ‘verdachte situatie’. De handelsvergunninghouders van een geneesmiddel zijn verantwoordelijk voor de continue monitoring van de risico’s van hun geneesmiddelen in overeenstemming met relevante wetgeving. Ze zijn vervolgens verplicht de resultaten te melden aan de juiste toezichthoudende instanties.
De handelsvergunninghouder is er ook verantwoordelijk voor dat alle toepasselijke acties worden uitgevoerd voor minimalisering van de risico’s van het geneesmiddel en maximalisering van de voordelen. Dit omvat de garantie dat alle informatie opgesteld door het bedrijf accuraat is met betrekking tot zijn geneesmiddelen, dat deze actief wordt bijgewerkt en dat nieuwe informatie wordt doorgegeven zodra deze bekend wordt.
Het tweede stadium van risicocommunicatie is identificeren en analyseren van het risico en dit beoordelen in relatie tot de voordelen. Dit neemt enige tijd in beslag en houdt in dat er sprake is van een periode van onzekerheid waarin uit voorzorg beslissingen moeten worden genomen. De volgende fase omvat evalueren en kwantificeren van de risico’s en voordelen. Dit wordt gevolgd door de selectie van een plan om risico’s te minimaliseren en voordelen te maximeren. Het laatste stadium is de implementatie van het plan.
Gedurende het gehele communicatieproces is het belangrijk dat er tijdig duidelijke en consistente boodschappen worden uitgedragen. De principes van communicatie over veiligheid/risico’s moeten worden toegepast. Deze principes zijn onder meer:
- adequate coördinatie en samenwerking tussen de verschillende betrokken partijen;
- boodschappen moeten relevant, duidelijk, accuraat en consistent zijn en op het juiste moment de juiste doelgroepen bereiken om actie te ondernemen;
- de communicatie moet worden afgestemd op de juiste doelgroep door geschikt taalgebruik te hanteren;
- de risicocommunicatie moet worden gepresenteerd in de context van de voordelen van de geneesmiddelen en moet beschikbare en relevante informatie over bijwerkingen bevatten;
- eventuele onzekerheden in samenhang met het veiligheidsprobleem moeten ook worden besproken;
- informatie over concurrerende risico’s moet waar van toepassing worden bijgevoegd;
- bij het beschrijven en vergelijken van risico’s moeten de geschiktste kwantitatieve maatregelen worden toegepast;
- wanneer het veiligheidsprobleem is opgelost, moet follow-upcommunicatie met aanvullende informatie worden gepubliceerd;
- de effectiviteit van de communicatie moet worden geëvalueerd.
Risicocommunicatie kent problemen. Obstakels zoals slechte rekenvaardigheid, onnauwkeurige bewoordingen en het kader (hoe het risico wordt gepresenteerd) kunnen van invloed zijn op hoe de informatie wordt ervaren.
Gezondheidsgeletterdheid is een van de grootste problemen van risicocommunicatie. Zowel patiënten als professionals kunnen moeite hebben met het interpreteren, opnemen en/of herinneren van risico-informatie, in het bijzonder wat betreft de statistische aspecten.
Voor patiënten geldt dat de meeste geneesmiddelen worden voorgeschreven door artsen en geleverd door apothekers. Management van de voordelen en risico’s door patiënten betreft hoofdzakelijk:
- zich houden aan behandelschema’s en aanbevelingen;
- zich bewust zijn van belangrijke risico’s en welke acties moeten worden ondernomen;
- melding van onwenselijke effecten aan hun arts, apotheker en nationale toezichthoudende instantie.
Afhankelijk van het land zijn er echter sommige geneesmiddelen die rechtstreeks kunnen worden gekocht zonder richtlijn van gezondheidszorgprofessionals (vrij verkrijgbare of zelfzorgmiddelen). Patiënten moeten de potentiële voordelen en risico’s van deze producten begrijpen en weten welke maatregelen ze moeten nemen voor een veilig en effectief gebruik van de geneesmiddelen.
Samenwerking met patiënten bij risicocommunicatie
De rol van patiënten bij risicocommunicatie is zeer belangrijk. Ze kunnen op verschillende manieren deelnemen:
- door verzameling van veiligheidsinformatie over hun ervaring met geneesmiddelen – dit is belangrijk aangezien ze direct worden geëffectueerd;
- door te worden geraadpleegd bij het opstellen van de conceptversies van veiligheids- of risicoboodschappen en het vooraf testen van dergelijke boodschappen om te zorgen dat ze relevant, duidelijk en begrijpelijk zijn;
- door betrokken te zijn bij de ontwikkeling van een aantal documenten die openbaar worden gemaakt – bijvoorbeeld samenvattingen van het Europees openbaar beoordelingsrapport (EPAR), bijsluiters en veiligheidscommunicatie;
- door regelmatig overleg te voeren met de verschillende belanghebbenden;
- door input en verspreiding van risicomededelingen in de media (sociale media, persberichten enz.)
Overige informatiebronnen
- Edwards, A. (2004) ‘Flexible rather than standardised approaches to communicating risks in health care’. British Medical Journal Quality & Safety, 13(3): 169-170. Geraadpleegd op 11 september 2015 op: http://qualitysafety.bmj.com/content/13/3/169.full.pdf+html
- Pfizer Inc. (2011). Understanding risk. Geraadpleegd op 11 september 2015 op: https://web.archive.org/web/20140202170937/http://www.pfizer.com/files/health/medicine_safety/1-2_Understanding_Risk.pdf
A2-5.27-v1.1