Last update: 3 sierpnia 2015
Wprowadzenie
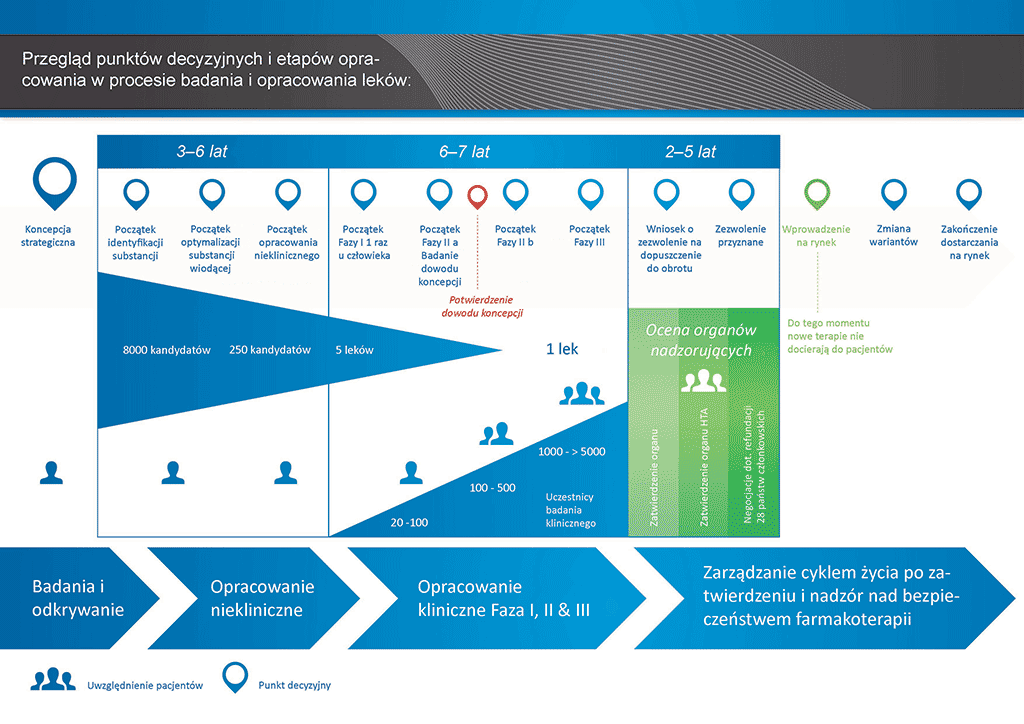
Przeprowadzenie wszystkich badań i prac koniecznych do wprowadzenia nowego leku na rynek zajmuje ponad 12 lat i kosztuje średnio ponad 1 mld euro.
Odkrywanie nowych leków jest przedsięwzięciem o wysokim ryzyku. Większość (około 98%) opracowywanych substancji nie trafia na rynek w postaci nowych leków. Zwykle powodem tego jest fakt, że korzyści i ryzyko (negatywne działania niepożądane) ujawniane w procesie rozwoju nie wytrzymują porównania z lekami już dostępnymi dla pacjentów.
Opracowanie nowego leku można podzielić na 10 etapów. Ten artykuł dotyczy etapu 9: wniosek o rejestrację i wystąpienie o pozwolenie na dopuszczenie do obrotu.
- Proces opracowania leku zajmuje ponad dziesięć lat planowania i badań pozwalających przejść od cząsteczki do dostępnego na rynku leczenia.
Etap 9: wniosek o rejestrację (wniosek o wydanie pozwolenia na dopuszczenie do obrotu)
Jeśli wyniki badań klinicznych Fazy III wykazują akceptowalną relację korzyści do ryzyka, można przygotować wniosek o wydanie pozwolenia na dopuszczenie do obrotu (MAA). We wniosku wszystkie informacje (niekliniczne, kliniczne i dotyczące produkcji) zostają zebrane i przedstawione przy użyciu wcześniej określonego formatu. Jest to wniosek wraz z dokumentacją, który zostaje wysłany do odpowiednich władz. Istotne znaczenie ma doświadczenie pracowników działów rejestracji, ponieważ różne organy nadzorujące na świecie mają nieco różniące od siebie wymagania.
Organizacja ICH (International Committee on Harmonisation) zharmonizowała wiele wymagań amerykańskich, europejskich i japońskich. Dzięki temu ograniczono powielanie testów i uproszczono proces, z którym można się zapoznać we Wspólnym Dokumencie Technicznym.
Po otrzymaniu wniosku organ nadzorujący zapoznaje się z informacjami i przesyła pytania do pracowników działu rejestracji firmy, która wysłała dokument. Jeśli organ nadzorujący uzna, że wyniki są zadowalające (ocena ryzyko-korzyść), wydaje pozwolenie na dopuszczenie nowego leku do obrotu. Ten proces kontrolny trwa zwykle od 12 do 18 miesięcy. W szczególnych wypadkach, po uzgodnieniu z organem nadzorującym, ten okres może być krótszy, ale może też zostać przedłużony, jeśli istnieje wiele wątpliwości. Władze mogą uznać, że wydanie zgody wymaga przeprowadzenia większej ilości badań klinicznych. Lek nie uzyska zgody na wprowadzenie do obrotu, dopóki nie zostaną spełnione wszystkie wymagania organów nadzorujących. Zdarzają się sytuacje, których władze nie mogą zaakceptować, i w efekcie lek nie zostanie zatwierdzony do wprowadzenia na rynek.
Wiele krajów wymaga także przeprowadzenia badań dotyczących efektywności kosztowej stosowania nowego leku. Takie dokumenty umożliwią rządowi lub towarzystwom ubezpieczeniowym korzystającym z usług grup oceny technologii medycznych (Health Technology Assessment, HTA) podejmowanie decyzji i formułowanie zaleceń dotyczących zezwoleń na przepisywanie leku i umieszczanie go na krajowych listach leków refundowanych.
Jednym z dobrze znanych organów oceny technologii medycznych jest brytyjski instytut NICE (National Institute for Clinical Excellence). NICE udziela rekomendacji dotyczących pozwolenia przez władze na przepisywanie leku.
Piśmiennictwo
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Załączniki
- Arkusz informacyjny: wniosek o rejestrację
Size: 97,467 bytes, Format: .docx
Ten arkusz informacyjny dotyczy działań związanych z przesłaniem ostatecznego dossier leku do organów nadzorujących w ramach przygotowania do możliwego wprowadzenia leku na rynek.
- Prezentacja: Podstawowe zasady dotyczące odkrywania i rozwoju leków
Size: 920,260 bytes, Format: .pptx
Podstawowe zasady dotyczące odkrywania i rozwoju leków. Przeprowadzenie wszystkich badań i prac koniecznych do wprowadzenia nowego leku na rynek zajmuje ponad 12 lat i kosztuje ponad 1 mld euro. W tej prezentacji szczegółowo przedstawiono proces od odkrycia nowego leku do wprowadzenia go na rynek oraz późniejsze działania.
A2-1.02.8-v1.1