Last update: 3 sierpnia 2015
Wprowadzenie
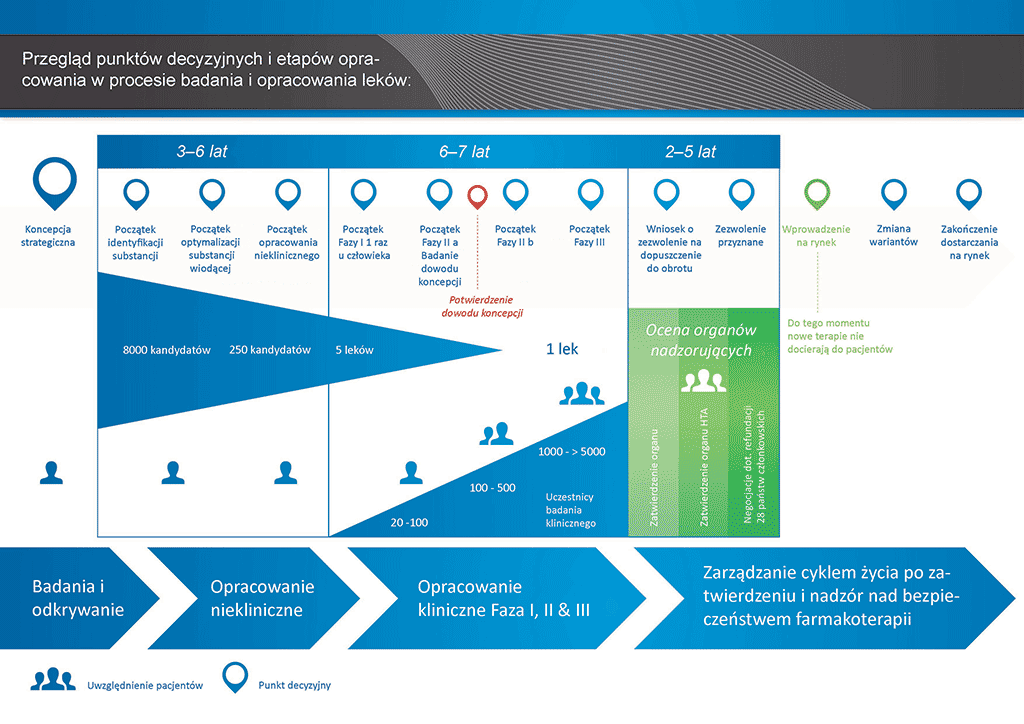
Przeprowadzenie wszystkich badań i prac koniecznych do wprowadzenia nowego leku na rynek zajmuje ponad 12 lat i kosztuje średnio ponad 1 mld euro.
Odkrywanie nowych leków jest przedsięwzięciem o wysokim ryzyku. Większość (około 98%) opracowywanych substancji nie trafia na rynek w postaci nowych leków. Zwykle powodem tego jest fakt, że korzyści i ryzyko (negatywne działania niepożądane) ujawniane w procesie rozwoju nie wytrzymują porównania z lekami już dostępnymi dla pacjentów.
Opracowanie nowego leku można podzielić na 10 etapów. Ten artykuł dotyczy etapu 7: badania typu „Proof of Concept” — badania kliniczne Fazy II
- Proces opracowania leku zajmuje ponad dziesięć lat planowania i badań pozwalających przejść od cząsteczki do dostępnego na rynku leczenia.
Etap 7: badania typu „Proof of Concept” — badania kliniczne Fazy II
Badania z udziałem pacjentów. Po wykazaniu bezpieczeństwa badania z udziałem ochotników kolejnym etapem jest rozpoczęcie badań klinicznych z udziałem pacjentów cierpiących na daną chorobę. Badań tych dotyczą takie same wytyczne i przepisy, jakie mają zastosowanie do badań Fazy I.
W badaniach Fazy II i Fazy III zwykle występują dwie grupy leczenia. Jedna z nich otrzymuje aktywny lek, a druga najlepsze dostępne leczenie lub produkt nieaktywny, niewpływający na organizm (inaczej placebo). Takie badania są zwykle prowadzone jako „podwójnie zaślepione”, „randomizowane”.
- „Podwójnie zaślepione” oznacza, że ani lekarz, ani uczestnik nie wie, kto otrzymuje aktywny lek, a kto najlepsze dostępne leczenie/placebo.
- „Randomizowane” oznacza, że przydział do grupy leczenia odbywa się losowo. Zwykle używa się do tego komputera generującego losowy kod. Na wybór nie może mieć wpływu lekarz ani nikt inny.
- „Z grupą kontrolną otrzymującą placebo” oznacza, że niektórzy uczestnicy otrzymają placebo podawane w takich samych warunkach jak lek aktywny. Dzięki temu można wydzielić działania związane z lekiem. Na przykład, jeśli uczestnik badania skarży się na ból głowy, ważne jest, aby wiedzieć, czy jest on związany z aktywnym lekiem. Jeśli taka sama liczba uczestników otrzymujących placebo skarży się na bóle głowy, dowodzi to, że jedynym powodem ich występowania nie może być aktywny lek.
Wszystkie szczegóły dotyczące badania są przedstawione w Protokole badania, a informacje zawiera Karta Obserwacji Klinicznej (CRF). Do analizowania wyników wykorzystuje się testy statystyczne.
W badaniach tego typu zwykle bierze udział od 100 do 500 pacjentów. Mają one dostarczać informacji dotyczących oddziaływania leku na daną chorobę (badanie typu „Proof of concept”). Jest to także etap, na którym stosuje się różne dawki leku, aby znaleźć najodpowiedniejszą. Ta dawka jest następnie stosowana w kolejnej fazie większych badań klinicznych.
Im więcej informacji na temat efektów podawania leku pacjentom uda się zebrać na tym etapie, tym łatwiej będzie zdecydować, czy prace nad cząsteczką „kandydującą” mają być kontynuowane. Jednak badania Fazy II są za małe, aby mogły dostarczyć wystarczających dowodów skuteczności i bezpieczeństwa. Należy więc zgromadzić jak najwięcej informacji na temat działania leku na pacjentów, aby zmniejszyć ryzyko niepowodzenia na następnym etapie (Faza III lub przygotowanie do rejestracji), stanowiącym najbardziej skomplikowaną i kosztowną fazę rozwoju leku.
Ponieważ badania Fazy II obejmują udział pacjentów, są zwykle prowadzone w kilku ośrodkach szpitalnych przez lekarzy zwanych badaczami — inaczej niż w Fazie I przeprowadzanej w specjalnych placówkach.
Jednoczesne prowadzenie badań w kilku ośrodkach jest bardziej skomplikowane niż w przypadku jednego ośrodka:
- Wszyscy badacze i pielęgniarki biorące udział w badaniu muszą zostać przeszkoleni przy użyciu tego samego protokołu, aby badanie było realizowane w taki sam sposób we wszystkich placówkach.
- Lek musi być wysyłany do różnych krajów i prawidłowo przechowywany w różnych aptekach.
- Próbki krwi pobrane od pacjentów w trakcie badania klinicznego są zwykle wysyłane do jednego laboratorium centralnego.
- Należy znać wszystkie lokalne prawa i przepisy oraz przestrzegać ich.
- Opinia Komisji Bioetycznej i zgoda właściwego organu krajowego (NCA) jest wymagana w każdym kraju.
Wszystkie te działania koordynuje globalny zespół prowadzący badanie.
Podsumowanie: Etapy 1-7
Do zakończenia badań Fazy II program:
- zajmuje średnio 8,5 roku oraz
- kosztuje średnio 1 mln euro.
Spośród każdych 10 leków badanych w Fazie I i Fazie II średnio zaledwie 2 przechodzą do kolejnej fazy badań.
Piśmiennictwo
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Załączniki
- Arkusz informacyjny: Badanie typu „Proof of concept”
Size: 97,989 bytes, Format: .docx
Ten arkusz informacyjny dotyczy badań klinicznych Fazy II — lub badań typu „Proof of mechanism”. Badania takie są przeprowadzane z udziałem niewielkiej liczby pacjentów cierpiących na chorobę stanowiącą cel; służą do ustalenia działania cząsteczki „kandydującej” na chorobę.
- Prezentacja: Podstawowe zasady dotyczące odkrywania i rozwoju leków
Size: 920,260 bytes, Format: .pptx
Podstawowe zasady dotyczące odkrywania i rozwoju leków. Przeprowadzenie wszystkich badań i prac koniecznych do wprowadzenia nowego leku na rynek zajmuje ponad 12 lat i kosztuje ponad 1 mld euro. W tej prezentacji szczegółowo przedstawiono proces od odkrycia nowego leku do wprowadzenia go na rynek oraz późniejsze działania.
A2-1.02.6-v1.1