Last update: 3 August 2015
Einleitung
Es dauert über 12 Jahre und kostet durchschnittlich mehr als eine Milliarde Euro, all die Forschungs- und Entwicklungsarbeiten durchzuführen, die erforderlich sind, bis ein neues Arzneimittel für die Behandlung von Patienten zur Verfügung steht.
Arzneimittelentwicklung ist ein risikoreiches Geschäft. Der größte Teil (ca. 98 %) neu entwickelter Wirkstoffe schafft es nicht, als neues Arzneimittel auf den Markt zu gelangen. Das liegt daran, dass das Verhältnis zwischen dem Nutzen und den im Verlauf der Entwicklung festgestellten Risiken (schädliche Nebenwirkungen) dem Vergleich mit anderen, bereits für die Behandlung von Patienten verfügbaren Arzneimitteln meist nicht standhält.
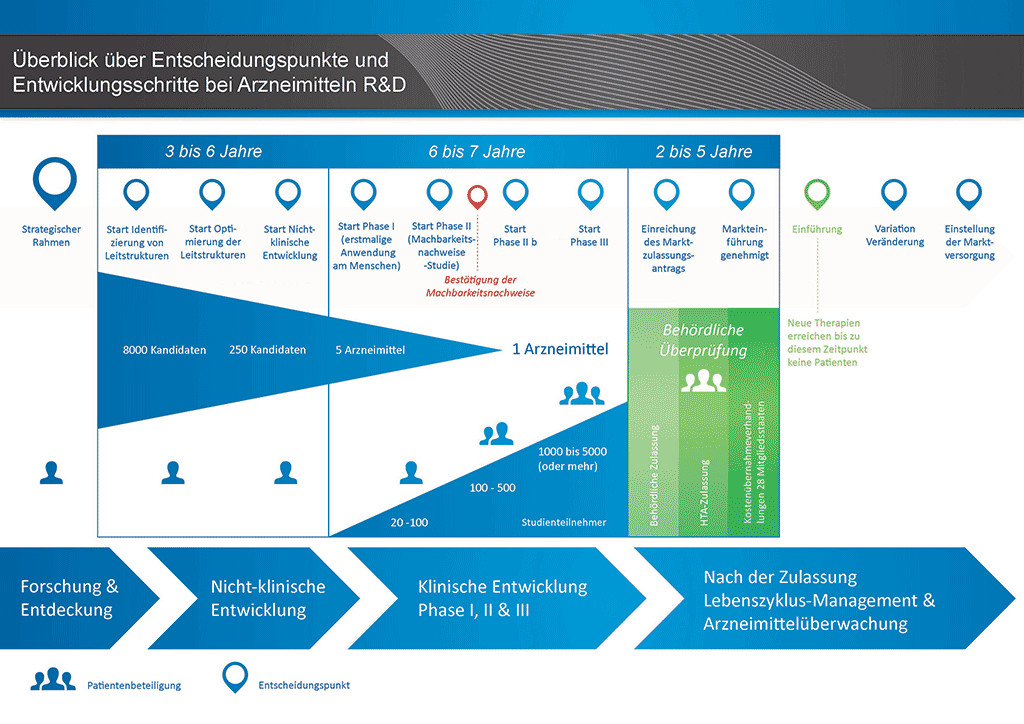
Die Entwicklung eines neuen Arzneimittels kann in zehn unterschiedliche Schritte unterteilt werden. Der folgende Artikel behandelt Schritt 7: Nachweis der Machbarkeit – Klinische Phase-II-Studien.
- Es benötigt mehr als 10 Jahre sorgfältiger Planung und Forschung, bis ein Arzneimittel sich vom Molekül zur marktfähigen Behandlung entwickelt hat.
Schritt 7: Nachweis der Machbarkeit – Klinische Phase-II-Studien
Studien an Patienten. Sobald die Ergebnisse von Studien mit freiwilligen Probanden gezeigt haben, dass es sicher ist, fortzufahren, werden im nachfolgenden Schritt klinische Untersuchungen an Patienten mit der betreffenden Krankheit begonnen. Hier finden dieselben Richtlinien und Bestimmungen wie bei Phase-I-Studien Anwendung.
Bei Phase-II- und Phase-III-Studien findet man in der Regel zwei Behandlungsgruppen. Eine Gruppe erhält das wirksame Arzneimittel, und die andere Gruppe erhält die derzeit beste Behandlung oder ein Scheinarzneimittel („Placebo“), das keinerlei Wirkung auf den Körper hat. Diese Studien werden normalerweise als „doppelt verblindete“, „randomisierte“ Studien durchgeführt.
- „Doppelt verblindet“ bedeutet, dass weder der Arzt noch der Patient weiß, wer das aktive Arzneimittel und wer die derzeit beste Behandlung bzw. das Placebo erhält.
- „Randomisiert“ bedeutet, dass die Behandlungsgruppen nach dem Zufallsprinzip zusammengestellt werden. Dies erfolgt üblicherweise mittels computergenerierter Zufallscodes, die weder vom Arzt noch anderen Personen beeinflusst werden können.
- „Placebokontrolliert“ bedeutet, dass einige Teilnehmer ein Placebo erhalten, das unter denselben Bedingungen verabreicht wird wie das aktive Arzneimittel. Auf diese Weise können die dem Arzneimittel zuzuordnenden Wirkungen aus der Gesamtheit der Beobachtungen separiert werden. Wenn z. B. ein Studienteilnehmer über Kopfschmerzen klagt, ist es wichtig zu wissen, ob diese mit dem aktiven Arzneimittel zusammenhängen. Wenn die gleiche Anzahl von Placebo erhaltenden Teilnehmern über Kopfschmerzen klagt, zeigt dies, dass die Kopfschmerzen nicht alleine dem aktiven Arzneimittel zugeschrieben werden können.
Sämtliche Einzelheiten der Studie sind im Studienprotokoll beschrieben. Sämtliche anfallenden Informationen werden in den Prüfbögen (Case Record Form, CRF) erfasst. Die Ergebnisse werden dann mittels statistischer Verfahren analysiert.
Diese Studien werden in der Regel an 100 bis 500 Patienten durchgeführt. Sie sind darauf ausgelegt, Informationen über die Wirkung des Arzneimittels auf die eigentliche Krankheit zu sammeln („Proof of Concept“, Machbarkeitsnachweis). Dies ist zudem das Stadium, in dem verschiedene Dosierungen des Arzneimittels verabreicht werden, um die bestmögliche Dosis zu finden. Diese Dosis wird dann für die nächste Phase, d. h. die größeren klinischen Studien verwendet.
Je mehr in diesem Stadium über die Wirkung bei Patienten in Erfahrung gebracht werden kann, desto einfacher ist es zu entscheiden, ob die Entwicklung des Wirkstoffkandidaten fortgesetzt werden sollte. Phase-II-Studien sind jedoch zu klein, um genügende Beweise hinsichtlich Wirksamkeit und Sicherheit liefern zu können. Daher wird mit dem steigenden Zuwachs an Informationen darüber, wie das Arzneimittel bei Patienten wirkt, die Gefahr eines Scheiterns im nächsten Stadium (Phase III oder „Entwicklung zur Produkteinführung“), der schwierigsten und kostspieligsten Phase der Entwicklung, verringert.
Da Phase-II-Studien an Patienten durchgeführt werden, finden sie – anders als die an speziellen Einrichtungen durchgeführten Phase-I-Studien – in der Regel an verschiedenen Krankenhäusern und unter der Leitung von Krankenhausärzten (Prüfern) statt.
Die Durchführung einer Studie an verschiedenen Standorten gleichzeitig ist komplizierter als die Durchführung einer Studie an einem einzigen Standort:
- Sämtliche Prüfer und Studienassistenten müssen anhand eines vorgegebenen Protokolls ausgebildet werden, damit die Studie an allen Standorten gleich durchgeführt wird.
- Das Arzneimittel muss in verschiedene Länder exportiert und in den verschiedenen Apotheken sachgerecht gelagert werden.
- Blutproben, die den Patienten im Rahmen der klinischen Studien abgenommen werden, werden in der Regel an ein einziges zentrales Labor geschickt.
- Sämtliche landesspezifischen Regeln und Bestimmungen müssen verstanden und befolgt werden.
- Das Votum der Ethik-Kommission und die Genehmigung der zuständigen nationalen Aufsichtsbehörde sind in der Regel in jedem Land erforderlich.
Alle diese Aktivitäten müssen vom globalen Studienteam koordiniert werden.
Zusammenfassung: Schritte 1 bis 7
Am Ende der Phase-II-Studien hat das Programm
- im Mittel 8,5 Jahre gedauert
- im Mittel 1 Milliarde Euro gekostet
Von zehn Arzneimitteln, die in Phase I und Phase II getestet wurden, werden nur zwei (im Durchschnitt) in die nächste Phase eintreten.
Quellenangaben
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Anlagen
- Datenblatt: Machbarkeitsnachweis
Size: 98,115 bytes, Format: .docx
Dieses Datenblatt behandelt klinische Phase-II-Studien (Studien zum Nachweis des Wirkmechanismus). Diese Studien werden an einer kleinen Zahl von Patienten, die von der Zielerkrankung betroffen sind, durchgeführt, um herauszufinden, ob sich der Wirkstoffkandidat auf die Erkrankung auswirkt.
- Präsentation: Die grundlegenden Prinzipien der Arzneimittelentdeckung und -entwicklung
Size: 945,895 bytes, Format: .pptx
Die grundlegenden Prinzipien der Arzneimittelentdeckung und -entwicklung. Es dauert über 12 Jahre und kostet mehr als eine Milliarde Euro, all die Forschungs- und Entwicklungsarbeiten durchzuführen, die erforderlich sind, bis ein neues Arzneimittel für die Behandlung von Patienten zur Verfügung steht. Diese Präsentation stellt die Details des Prozesses von der Entdeckung bis zur Markteinführung eines neuen Arzneimittels und darüber hinaus vor.
A2-1.02.6-v1.1