Last update: 13 stycznia 2016
Wprowadzenie
Ocena technologii medycznych (ang. Health Technology Assessment, HTA) jest multidyscyplinarnym procesem, który podsumowuje informacje na temat kwestii medycznych, społecznych, ekonomicznych i etycznych związanych z korzystaniem z danej technologii medycznej w sposób systematyczny, przejrzysty, bezstronny i pełny. Celem oceny jest dostarczenie informacji potrzebnych do stworzenia bezpiecznych i skutecznych polityk zdrowotnych skoncentrowanych na pacjencie oraz chęć osiągnięcia najlepszej jakości. Pomimo własnych celów politycznych, ocena HTA musi być zawsze mocno oparta na badaniach i metodzie naukowej.
Biorąc pod uwagę ocenę HTA w zakresie produktów leczniczych, warto wiedzieć jak leki są rejestrowane i posiadać podstawową wiedzę na temat cyklu życia produktu i procesów, które prowadzą do dopuszczenia do obrotu. Warto też wiedzieć, w jaki sposób ocena HTA wpisuje się w system refundacyjny lub ubezpieczeniowy w różnych krajach. Firma farmaceutyczna musi prowadzić wysokiej jakości, randomizowane badania kliniczne i złożyć dokumentację wniosku do właściwego organu regulacyjnego. Po otrzymaniu pozwolenia na dopuszczenie do obrotu produktu, w oparciu o informacje dotyczące bezpieczeństwa, jakości i skuteczności, produkt można wprowadzić na rynek (można go sprzedawać). W celu zapewnienia pacjentom powszechnego dostępu do niezbędnego leczenia, często konieczne jest włączenie produktu do krajowego systemu opieki zdrowotnej lub objęcie go ubezpieczeniem. Oznacza to, że produkt może się znaleźć na odpowiedniej krajowej liście refundacyjnej lub jest objęty ubezpieczeniem.
W tym samym czasie ci sami płatnicy instytucyjni muszą zarządzać dostępem do innowacyjnych metod leczenia dysponując ograniczonym budżetem. Ze względu na te ograniczenia, płatnicy chcą być pewni, że płacą za nowe technologie, które oferują rzeczywiste polepszenie wyników leczenia. I tu w grę wchodzi HTA z podstawowym zadaniem mającym na celu określenie terapeutycznej wartości dodanej (w zakresie skutków zdrowotnych dla pacjentów) nowej technologii w porównaniu do obecnie stosowanych standardów opieki medycznej.
Na początku najlepiej zorientować się, które organizacje są głównymi graczami w tym procesie. W Europie istnieją różne organy odpowiedzialne za farmaceutyczną i niefarmaceutyczną ocenę technologii medycznych (HTA). Struktury, funkcje, kompetencje i podejścia tych organów różnią się w zależności od różnych systemów opieki zdrowotnej i struktur politycznych, w których działają.
Przykładowe organy ds. HTA zajmujące się oceną farmaceutyczną w Europie:
- Francja — Haute Autorité de Santé (HAS) — http://www.has-sante.fr
- Niemcy — Gemeinsamer Bundesausschuss (GBA) — https://www.g-ba.de/
- Szkocja — Scottish Medicines Consortium (SMC) — scottishmedicines.org.uk/Home
- Szwecja — Tåndvards Och Läkemedelsförmänsverket (TLV) — tlv.se/In-English/in-english/
Należy pamiętać, że w Niemczech etap oceny procesu HTA jest przeprowadzany w instytucie IQWIG (Instytut Jakości i Efektywności w Ochronie Zdrowia), a weryfikacja i podjęcie decyzji odbywają się w GBA. Należy również zauważyć, że w niektórych krajach europejskich organ ds. HTA prowadzi również oceny interwencji o charakterze niefarmakologicznym takich jak wyroby medyczne, zabiegi chirurgiczne oraz (w niektórych przypadkach) interwencji w zakresie zdrowia publicznego. Należą do nich:
- Norwegia — NOKC (The Norwegian Knowledge Centre, Nasjonalt kunnskapssenter for helsetjenesten) — https://www.fhi.no/en/
- Szwecja — SBU ( Swedish Agency for Health Technology Assessment and Assessment of Social Services) — http://www.sbu.se/en/
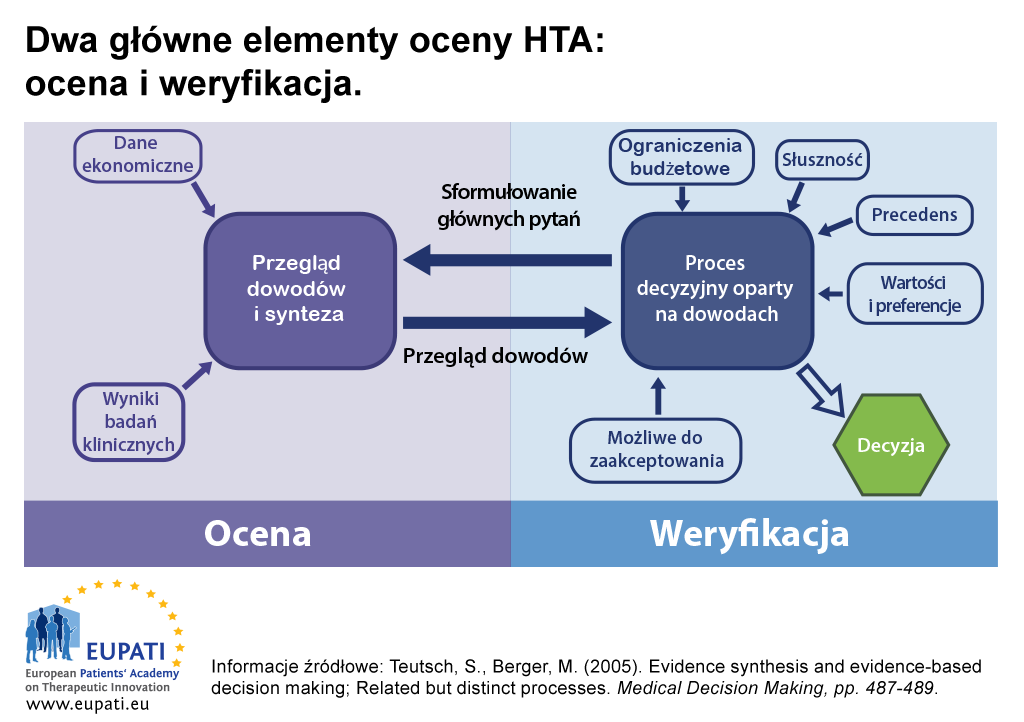
Istnieją dwa główne elementy oceny HTA: Ocena i weryfikacja.
- Wzajemne zależności między oceną i weryfikacją dostarczają informacji potrzebnych do podjęcia decyzji w procesie oceny technologii medycznych (HTA).
- Wzajemne zależności między oceną i weryfikacją dostarczają informacji potrzebnych do podjęcia decyzji w procesie oceny technologii medycznych (HTA).
W niektórych krajach ocenę i weryfikację procesu HTA mogą prowadzić odrębne organy.
- Jedna jednostka może zajmować się oceną — syntezą dowodów lub krytycznym przeglądem zgłoszonych dowodów.
- Inna jednostka może zajmować się weryfikacją — rozpatrzeniem oceny w świetle szerszych czynników widzianych w lokalnym kontekście. Następnie udzielają porad lub wydają zalecenia.
HTA: Ocena
Oceny HTA dotyczące leków zazwyczaj rozpoczynają się od złożenia przez firmę dokumentacji zawierającej odpowiednie informacje do organu ds. HTA. W przypadku interwencji innych niż dotyczących leków, organy ds. HTA zwykle dokonują systematycznego przeglądu opublikowanych informacji. Domyślnie, dokumentacja zawiera szczegółowe dane dotyczące bezpieczeństwa i skuteczności nowej technologii, a także „dodatkowe korzyści kliniczne” — innymi słowy porównanie skuteczności klinicznej nowego produktu z istniejącym standardowym sposobem leczenia (lekiem referencyjnym).
Niektóre systemy HTA w Europie oceniają również ewentualny wpływ nowego produktu na budżet systemu ochrony zdrowia (ocena wpływu na budżet) lub efektywność leku w porównaniu do kosztów ponoszonych przez system (na przykład analizy opłacalności lub ocena ekonomiczna). Nie wszystkie systemy HTA w Europie kładą taki sam nacisk na porównawczą analizę opłacalności, ale wszystkie skupiają się na dodatkowej korzyści klinicznej.
Najczęściej spotykane elementy składanej dokumentacji lub „wniosku” podano poniżej: należy zauważyć, że niektóre z tych elementów są bardziej ilościowe niż inne. Słuszność, kwestie prawne i dotyczące zdrowia publicznego mogą być bardziej jakościowe, a zatem można je uwzględnić na etapie weryfikacji HTA, a nie oceny.
- Docelowa populacja pacjentów: Dana populacja, której leczenie będzie refundowane (określona w oparciu o uprawnione wskazanie lub podgrupa).
- Obciążenie chorobą: Znane również jako „niezaspokojona potrzeba” lub „potrzeba terapeutyczna”. Może stanowić miarę liczby osób dotkniętych konkretną chorobą, dla których obecnie stosowane sposoby leczenia są niewystarczające. Może dotyczyć liczby nowych rozpoznań choroby lub koszty społeczne bądź rządowe reprezentujące poszkodowanych. Może również obejmować bardziej jakościowe aspekty dotyczące obciążenia chorobą i obecnie dostępne metody leczenia.
- Opis leku Opis leku, sposobu działa, sposobu podawania (np. w postaci zastrzyku, tabletki), miejsca podawania pacjentom (np. w szpitalu, poza szpitalem, w jednostce podstawowej opieki medycznej, w domu), częstotliwości podawania oraz odpowiedniego zastosowania w terapii skojarzonej z innymi lekami i interwencjami.
- Skuteczność kliniczna: W medycynie skuteczność kliniczna wskazuje pozytywny efekt leczniczy. O skuteczności mówi się wówczas, jeżeli interwencja jest przynajmniej tak dobra jak inne dostępne interwencje, do których ją porównano.Mówiąc w kategoriach skuteczności i efektywności, skuteczność dotyczy działania leczenia podczas badań klinicznych lub laboratoryjnych. Efektywność natomiast wskazuje, jak leczenie sprawdza się w praktyce.
- Skuteczność względna: Jest to zakres, w którym interwencja przynosi więcej korzyści niż szkody w idealnych warunkach, w porównaniu do jednej lub większej liczby alternatywnych interwencji.
- Efektywność kliniczna: Efektywność kliniczna jest miarą tego, jak leczenie sprawdza się w praktyce. Zależy od zastosowania najlepszej wiedzy opartej na badaniach, doświadczenia klinicznego i preferencji pacjenta.
- Efektywność kliniczna względna: Może być zdefiniowana jako zakres, w którym interwencja przynosi więcej korzyści niż szkody w porównaniu do jednej lub większej liczby alternatywnych interwencji mających na celu osiągnięcie pożądanych wyników w zwykłych warunkach opieki zdrowotnej.
- Ocena ekonomiczna i opłacalność: W kontekście farmakoekonomiki opłacalność jest badana na drodze obserwacji wyników różnych interwencji poprzez pomiar pojedynczego wyniku zwykle w jednostkach „naturalnych” (np. zyskanych lat życia, przypadków uniknięcia śmierci, przypadków uniknięcia ataków serca lub wykrytych przypadków).Następnie alternatywne interwencje są porównywane pod względem kosztów w przeliczeniu na (naturalną) jednostkę skuteczności, aby sprawdzić, czy dana procedura jest warta swojej ceny. Pomaga to decydentom określić, gdzie przeznaczyć ograniczone zasoby w ochronie zdrowia.Opłacalność jest jednak tylko jednym z wielu kryteriów, które należy brać pod uwagę w trakcie podejmowania decyzji o ewentualnym dopuszczeniu interwencji. Inne kwestie, takie jak słuszność, potrzeby, wpływ na życie zawodowe i priorytety pacjenta powinny być również częścią oceny ekonomicznej.
- Wpływ na budżet: Koszty ponoszone w określonym czasie i związane z określonym budżetem przeznaczonym na opiekę zdrowotną, a nie całym budżetem danego kraju. Zakłada wiarygodne dane dotyczące epidemiologii i sposobów leczenia wraz z założeniami na temat przyjęcia i wyeliminowania obecnie stosowanych metod leczenia.
- Charakterystyka innowacyjności: Ocena czy istnieje korzyść stosowania leku wykraczająca poza dodatkową korzyść kliniczną (taką jak udogodnienia dla pacjentów, na przykład innego trybu podawania leku lub inne cechy, które mogą poprawić stopień stosowania się do zaleceń lekarskich, co powoduje poprawę wyników klinicznych i/lub jakość życia).
- Dostępność zamienników terapeutycznych: Opis innych możliwych sposobów leczenia choroby. Inny lek może być dostępny lub taki lek nie istnieje.
- Zagadnienia dotyczące słuszności zastosowania: Ocena wpływu zastosowania nowej terapii na równość w dostępie w ramach systemu opieki zdrowotnej. Na przykład, czy terapia przyniesie więcej korzyści osobom pokrzywdzonym społecznie lub ekonomicznie?
- Wpływ na zdrowie publiczne: Badanie nad sposobem, w jaki nowa terapia może bardziej oddziaływać na zdrowie publiczne. Na przykład nowa terapia w leczeniu HIV/AIDS może zmniejszyć szybkość rozprzestrzeniania się wirusa HIV w społeczeństwie.
Większość organów ds. HTA opracowała wytyczne dla firm w celu uspójnienia procesu i stworzenia sprawiedliwych porównań. Jednak wytyczne są różne w poszczególnych krajach. Mogą być dostępne na stronach internetowych większości organów ds. HTA i mogą pomóc w wyjaśnieniu sposobu podejmowania decyzji dotyczących nowych leków.
Dokumentacje są badane przez organy ds. HTA lub jednostki akademickie. Niektóre organy ds. HTA prowadzą niezależne weryfikacje dowodów klinicznych i ekonomicznych w celu zmniejszenia ryzyka konfliktu interesów.
HTA: Weryfikacja
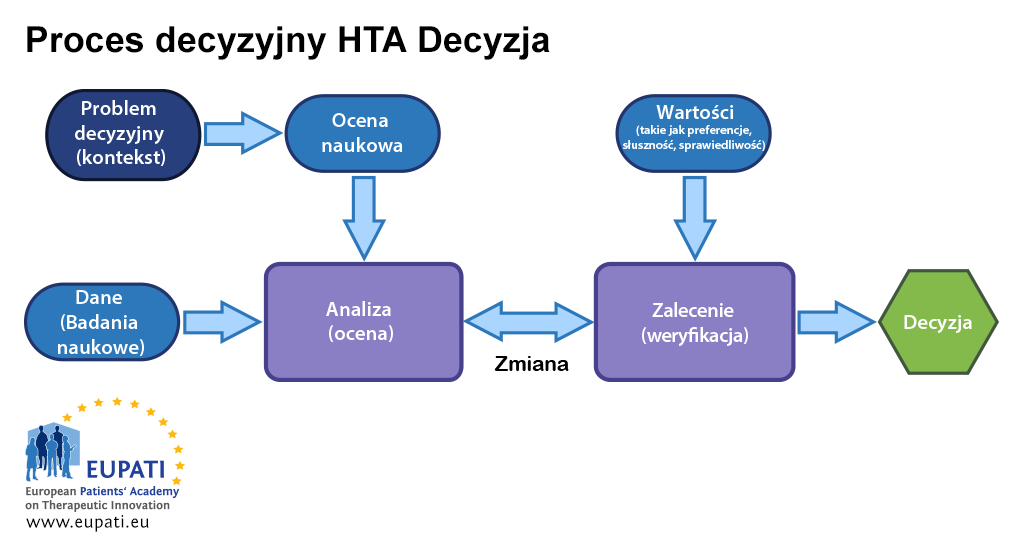
Podjęcie decyzji na temat refundacji nowej technologii medycznej może być kontrowersyjne. Dlatego najlepszym rozwiązaniem w praktyce jest oddzielenie oceny od procesu weryfikacji oraz podjęcia decyzji. Zazwyczaj podmioty prowadzące weryfikacje będą opierać zalecenia na wynikach oceny dowodów, a także danych dodatkowych, takich jak lokalna polityka zdrowotna, wartości oraz zeznania pacjentów.
Oceny HTA na ogół skutkują podjęciem decyzji o ewentualnym umieszczeniu nowej technologii na liście refundacyjnej właściwej dla systemu opartego na ubezpieczeniach (lista obejmuje produkty lecznicze, które są refundowane ze środków publicznego ubezpieczenia zdrowotnego) lub zaleceniem jego stosowania w ramach publicznej służby zdrowia finansowanej z podatków. Może być w postaci listy/zaleceń do stosowania leku w określonych warunkach, na przykład dla mniejszej populacji pacjentów z cięższą postacią choroby.
Ustalenie, czy interwencja obniży liczbę ataków serca, spowoduje znaczne działania niepożądane lub podwyższy koszty, wymaga orzeczenia co do wiarygodności dowodów. Zawsze istnieje niepewność, jeżeli chodzi o dowody. Oczywiście leży to w najlepszym interesie organu ds. HTA, aby wykorzystać solidną ocenę naukową oraz logiczne i przejrzyste podejścia, które prowadzą do uzasadnionej decyzji. Ze względu na multidyscyplinarny charakter oceny HTA, w celu wsparcia różnorodnych analiz, wymagane jest najlepsze podejście właściwe dla epidemiologii, socjologii, ekonomii, etyki, prawa, itp.
Podjęcie decyzji wymaga jednak uznania tego, co jest ważne dla społeczeństwa i pacjentów. Czy dobre jest zmniejszenie liczy zawałów serca? Jakim kosztem?
Dobre podejście dotyczące weryfikacji bierze pod uwagę różne punkty widzenia, a zatem nie może być w zadawalający sposób podjęte przez jedną osobę. Z tego powodu zostanie powołana komisja, która korzystając z odpowiednio doprecyzowanego i przejrzystego procesu doprowadzi do opracowania zaleceń. Proces ten jest często nazywany weryfikacją obradującą. Większość organów ds. HTA kładzie większy nacisk na „ogrom zysków” (i siłę dowodów) w istotnych dla pacjentów wynikach zdrowotnych obserwowanych w dobrze zaprojektowanych badaniach klinicznych wykorzystujących odpowiednie leki referencyjne.
Kolejnym ważnym aspektem są często względy ekonomiczne. Prawie wszystkie agencje zajmujące się oceną HTA biorą pod uwagę wpływ na budżet (łączna kwota dodana do budżetu systemu opieki zdrowotnej w określonym czasie na skutek stosowania nowego leku). Powinien to być budżet netto: po odliczeniu oszczędności, które mogły powstać w innych obszarach systemu opieki zdrowotnej w wyniku korzyści związanych z nowym lekiem (np. mniej hospitalizacji z powodu wystąpienia poważnych działań niepożądanych). Musi być zapewniona neutralność komitetu — innymi słowy, jego członkowie muszą formalnie zadeklarować brak jakiegokolwiek konfliktu interesów lub zrezygnować z udziału w jego pracach.
Niektóre organy ds. HTA przyjęły ramy etyczne, które umożliwiają weryfikację zaleceń przez szerszy krąg zainteresowanych stron. Dzięki temu mogą się odwołać firmy, lekarze lub pacjenci, którzy mogli zostać niesprawiedliwie potraktowani przez wadliwe, stronnicze lub nieprecyzyjne zalecenia.
W rzadkich przypadkach organy ds. HTA chcą poznać opinię obywateli na temat trudnych aspektów w procesie podejmowania decyzji podczas dyskusji nad priorytetami w ochronie zdrowia. Na przykład w Wielkiej Brytanii Państwowy Instytut Jakości Klinicznej (ang. National Institute for Health and Care Excellence, NICE) posiada Radę Obywatelską, która pełni rolę sądu obywatelskiego przekazującego opinie Komitetowi Oceniającemu przy NICE. Poniższa lista zawiera kwestie, przy których doradzała Rada Obywatelska.
| Rok | Temat |
|---|---|
| 2002 | Potrzeba kliniczna |
| 2003 | Wiek i opłacalność |
| 2004 | Leki sieroce stosowane w chorobach ultrarzadkich i opłacalność |
| 2005 | Obowiązkowe działania w zakresie zdrowia publicznego |
| 2006 | Korzystnie z obowiązku pomocy |
| 2007 | Bezpieczeństwo pacjenta i opłacalność |
| 2008 | Odchodzenie od progu inkrementalnego współczynnika efektywności kosztów (ang. incremental cost-effectiveness ratio, ICER) |
| 2009 | Innowacja |
| 2010 | Poprawa zdrowia i zachęty finansowe |
| 2011 | Obniżka kosztów i korzyści |
| 2012 | Wartości opieki społecznej |
W niektórych przypadkach, wyniki oceny HTA będą połączone z negocjacjami ceny. Negocjowanie ceny jest jednym z mechanizmów rządowych zapewnienia dostępu do nowych terapii (czyli znalezieniem sposobu, by nie powiedzieć „nie”). Inne zmienne dotyczą ograniczeń grupy osób, które będą mogły otrzymać lek w ramach refundacji.
Kwestie wykraczają poza rekomendacje
Zalecenia dotyczące tego, czy nowy lek może (lub nie) być udostępniony w ramach systemu opieki zdrowotnej może być uznane za zbyt sztywne i nie oferujące elastyczności przez te osoby, które potrzebują dostępu do nowych form terapii. Zalecenia te na ogół dotyczą populacji i dlatego mogą nie pozwolić na wyjątki w trybie indywidualnym. W miejsce zaleceń typu tak/nie organy do spraw HTA zastosowały inne mechanizmy, które mogą być bardziej pomocne.
- Refundacja z dodatkową oceną skuteczności leku: Ten mechanizm można zastosować, aby umożliwić dostęp do obiecującego nowego leku, w przypadku którego w chwili obecnej brak wystarczających danych na temat skuteczności klinicznej lub opłacalności. W tych okolicznościach organ ds. HTA może zalecić stosowanie leku pod warunkiem, że istnieje formalny zbiór dowodów, na przykład w rejestrze, umożlwiający rozwiązanie tych niepewności, gdy jest on stosowany. Lub może trwać badanie kliniczne, wymagane przez organy regulacyjne, które w pewnym momencie dostarczy dodatkowych dowodów.
- Ustalenie ceny: Cena technologii medycznej może mieć bezpośredni wpływ na dostęp dla dostawców i pacjentów do tej technologii. W niektórych przypadkach płatnicy mogą negocjować z firmą cenę na podstawie postrzeganej wartości technologii medycznej, zwłaszcza w sytuacji, gdy technologia medyczna jest przydatna w niektórych przypadkach, a w innych już nie. Takie podejście zapewnia, że dostawcy i pacjenci potrzebujący danej technologii uzyskają do niej dostęp. Organy ds. HTA mogą uczestniczyć w tym procesie bądź nie. Jednak wycena oparta na wartości stanowi wyzwanie, gdyż trudno zapewnić, że wszystkie aspekty dotyczące wartości technologii medycznych zostały odpowiednio potraktowane. Na przykład wyniki krótkoterminowych badań klinicznych nie mogą wykazywać właściwości produktu, które są cenne dla pacjentów np. dogodnych harmonogramów dawkowania lub mniej inwazyjnych metod podawania.
- Pomoce decyzyjne i wytyczne kliniczne: Ocena HTA może wykazać, że lek jest najbardziej wartościowy, gdy podaje się go szczególnej grupie pacjentów lub, gdy zostanie wykorzystany po zastosowaniu innych metod leczenia. Aby zoptymalizować wartość, płatnik może zadecydować o refundacji leku w połączeniu z konkretnymi wytycznymi klinicznymi (dla lekarzy) lub szczególnymi pomocami decyzyjnymi (dla pacjentów i lekarzy). Pomoce decyzyjne są narzędziami dla pacjentów i lekarzy do korzystania z dowodów w celu podejmowania indywidualnych decyzji. Pomagają pacjentom dokonać wyboru pomiędzy dwoma sposobami leczenia, które charakteryzują się różnymi zagrożeniami i korzyściami. Umożliwia to bardziej świadome rozmowy z lekarzami o tym, co dla pacjentów najważniejsze oraz pomaga w określeniu najlepszego dla pacjenta rozwiązania.1
- Ustalanie priorytetów w systemie ochrony zdrowia i budżety: Metody rozwijały się, aby wykorzystać informacje oceny HTA do określenia refundowanych usług (np. określenia usług objętych uniwersalnym ubezpieczeniem zdrowotnym). Jest to optymalna „mieszanka” zapewniająca wartość i niedroga dla płatnika.2
Sieci zrzeszające organy ds. HTA
Wiele organizacji zajmujących się oceną HTA w Europie jest ze sobą powiązanych poprzez sieć europejskich organizacji działających w obszarze HTA (EUnetHTA) utworzoną w 2004 r. EUnetHTA ściśle współpracuje z Komisją Europejską, Europejską Agencją Leków (EMA) oraz organizacjami reprezentującymi pacjentów/konsumentów, przemysł, płatników (ustawowe ubezpieczenie zdrowotne) oraz służbę zdrowia. EUnetHTA pracuje nad rozwojem metod, standardów i procesów na rzecz sieci HTA w Europie (Sieć HTA).
Sieć HTA będzie promować dobre praktyki i metody dotyczące oceny HTA w odpowiedzi na wysoką różnorodność metod, praktyk i wyników występujących w procesach HTA w Europie, a także powielania wysiłków. Będzie miała również na celu ułatwienie skutecznego wykorzystania zasobów HTA w Europie. Kluczowe działania podejmowane przez EUnetHTA na rzecz sieci HTA obejmują opracowanie wytycznych metod dotyczących HTA oraz pilotowanie wspólnych ocen względnej skuteczności. Działania te pomogą zmniejszyć obciążenia na poziomie krajowym oraz ułatwią organom ds. HTA w państwach członkowskich przeprowadzenie dodatkowych analiz i podjęcie decyzji specyficznych dla danego systemu ochrony zdrowia.
Inne materiały i zasoby
- Sieć organizacji działających w obszarze oceny technologii medycznych. Pobrano 6 stycznia 2016 r. ze strony https://ec.europa.eu/health/technology_assessment/policy/network
- EUnetHTA: http://www.eunethta.eu/ (Pobrano 6 stycznia 2016 r.)
- Szanse dla pacjentów zaangażowania się w działalność sieci EUnetHTA: http://www.eunethta.eu/ (Pobrano 6 stycznia 2016 r.).
- Sorenson, C., Drummond, M., and Panos, K. (2008). Ensuring value for money in health care: The role of health technology assessment in the European Union. Copenhagen: Światowa Organizacja Zdrowia. Pobrano 6 stycznia 2016 r. ze strony http://www.euro.who.int/__data/assets/pdf_file/0011/98291/E91271.pdf
- Velasco Garrido, M., Kristensen, F.B., Nielsen, C.P, and Busse, R. (2008). Health technology assessment and health policy-making in Europe: Current status, challenges and potential. Copenhagen: Światowa Organizacja Zdrowia. Pobrano 6 stycznia 2016 r. ze strony http://www.euro.who.int/__data/assets/pdf_file/0003/90426/E91922.pdf
- Kleinjen, S., George, E., Goulden, S., et al. (2012). ‘Relative effectiveness assessment of pharmaceuticals: similarities and differences in 29 jurisdictions’. Value Health, (15), 954-960. Pobrano 6 stycznia 2016 r. ze strony http://www.valueinhealthjournal.com/article/S1098-3015(12)01609-9/pdf
- Rawlins, M. (2014). ‘Evidence, values, and decision-making.’ International Journal of Technology Assessment in Health Care, (30), 233-238.
Piśmiennictwo
- Ottawa Hospital Research Institute (2014). Patient Decision Aids: Implementation Toolkit. Retrieved 6 January, 2016, from http://decisionaid.ohri.ca/implement.html
- Bandolier (2007). Programme budgeting and marginal analysis. Retrieved 6 January, 2016, from http://www.bandolier.org.uk/booth/glossary/PBMA.html
A2-6.05-v1.1