Last update: 13 januari 2016
Inleiding
Health Technology Assessment (HTA) is een multidisciplinair proces dat op systematische, transparante, onbevooroordeelde en degelijke wijze een samenvatting geeft van informatie over de medische, maatschappelijke, economische en ethische kwesties rond het gebruik van een gezondheidstechnologie. Het doel is informatie te verzamelen voor de formulering van een veilig en effectief gezondheidsbeleid dat de patiënt centraal stelt en de beste prijs-kwaliteitverhouding probeert te bereiken. Ondanks de beleidsmatige doelstellingen van HTA, moet het altijd stevig geworteld zijn in onderzoek en wetenschappelijke methoden.
Voor wat betreft HTA op het gebied van geneeskundige producten, is het nuttig om te weten hoe geneesmiddelen worden goedgekeurd en om een basiskennis te hebben van de levenscyclus van een product en de procedures die leiden tot het verlenen van een handelsvergunning. Het is ook nuttig om te weten hoe HTA past in het stelsel van vergoedingen en verzekeringen in elk afzonderlijk land. Het farmaceutische bedrijf moet hoogwaardige, gerandomiseerde klinische onderzoeken uitvoeren en een aanvraagdossier indienen bij de relevante toezichthoudende instantie. Zodra een product een handelsvergunning heeft gekregen op basis van veiligheid, kwaliteit en werkzaamheid, mag het product op de markt gebracht worden (mag het worden verkocht). Om wijdverspreide toegang tot de benodigde behandeling voor patiënten te garanderen, is het vaak nodig dat het product door een nationaal gezondheidszorgstelsel of verzekeraar wordt gedekt. Dit zou betekenen dat het product wordt opgenomen in het bijbehorende geneesmiddelenvergoedingssysteem of de verzekeringsdekking.
Tegelijkertijd moeten deze institutionele betalers de toegang beheren tot innovatieve behandelingen binnen een beperkt budget. Vanwege deze beperkingen willen betalers zeker weten dat ze betalen voor nieuwe technologieën die leiden tot daadwerkelijke verbeteringen in patiëntenuitkomsten. Dat is waar HTA in het spel komt, omdat de fundamentele rol ervan is om de toegevoegde therapeutische waarde (in termen van gezondheidsuitkomsten voor patiënten) vast te stellen van de nieuwe technologie in vergelijking met de huidige standaardzorg.
Om te beginnen is handig te weten welke organisaties de belangrijkste actoren zijn in dit proces. In Europa bestaan verschillende instanties die verantwoordelijk zijn voor zowel farmaceutische als niet-farmaceutische Health Technology Assessment (HTA). De structuur, de functie, het mandaat en de methoden van deze instanties verschillen afhankelijk van de verschillende gezondheidsstelsels en politieke structuren waarbinnen zij opereren.
Enkele voorbeelden van HTA-instanties voor farmaceutische beoordeling in Europa zijn:
- Frankrijk – Haute Autorité de Santé (HAS) – http://www.has-sante.fr
- Duitsland – Gemeinsammer Bundesausschuss (GBA) – https://www.g-ba.de/
- Schotland – Scottish Medicines Consortium (SMC) – scottishmedicines.org.uk/Home
- Zweden – Tåndvards Och Läkemedelsförmänsverket (TLV) – tlv.se/In-English/in-english/
In Duitsland wordt het evaluatieve deel van HTA uitgevoerd door IQWIG (Institute for Quality and Efficiency in Health Care), terwijl de waardebepaling en besluitvorming worden uitgevoerd door de GBA. In sommige Europese landen voert de HTA-instantie ook evaluaties uit van niet-farmacologische interventies zoals hulpmiddelen, chirurgische procedures en (in sommige gevallen) interventies op het gebied van volksgezondheid. Het gaat dan om:
- Noorwegen – NOKC (Het Noorse kenniscentrum, Nasjonalt kunnskapssenter for helsetjenesten) – https://www.fhi.no/en/
- Zweden – SBU (Zweeds bureau voor Health Technology Assessment en beoordeling van maatschappelijke diensten) – http://www.sbu.se/en/
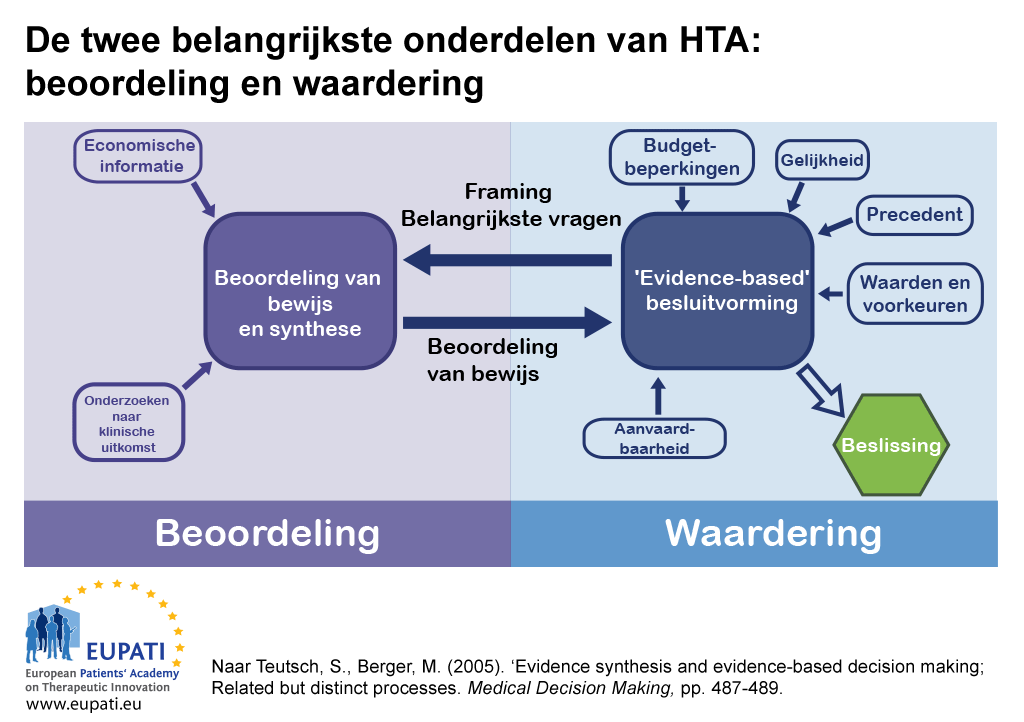
HTA omvat twee hoofdcomponenten: Beoordeling en waardebepaling.
- De wederkerige relatie tussen beoordeling en waardebepaling bepaalt de besluitvorming bij Health Technology Assessment (HTA).
In sommige landen worden de beoordeling en waardebepaling van een HTA uitgevoerd door verschillende instanties.
- De ene instantie houdt zich bezig met een beoordelingstaak – bewijsmateriaal bijeenvoegen of ingediend bewijs kritisch bestuderen.
- Een andere instantie kan gespecialiseerd zijn in waardebepaling – de beoordeling bezien in het licht van bredere factoren die verbonden zijn met de lokale context. Ze kunnen advies en aanbevelingen geven.
HTA: Beoordeling
HTA-procedures voor geneesmiddelen beginnen doorgaans met de indiening door een bedrijf van een dossier met relevante informatie bij een HTA-instantie. Voor interventies anders dan geneesmiddelen voeren HTA-instanties meestal een systematische beoordeling van gepubliceerde informatie uit. Standaard bevatten de dossiers gedetailleerd bewijs met betrekking tot de veiligheid en werkzaamheid van de nieuwe technologie evenals ‘klinische meerwaarde’ – met andere woorden, een vergelijking tussen de klinische effectiviteit van het nieuwe product en de bestaande standaardzorg (het vergelijkingsmiddel).
Sommige HTA-systemen in Europa berekenen ook de impact die het nieuwe product kan hebben op het budget van het gezondheidsstelsel (een budgettaire impactevaluatie) of de effectiviteit van het geneesmiddel in vergelijking met de kosten ervan (bijvoorbeeld een kosten-effectiviteitsanalyse of economische evaluatie). Niet alle HTA-systemen in Europa leggen dezelfde nadruk op vergelijkende kosten-effectiviteitsanalyse, maar ze zijn wel allemaal gefocust op de klinische meerwaarde.
De meest gebruikelijke componenten van een aanvraagdossier of ‘aanvraag’ staan hieronder genoemd. Let op: sommige van deze componenten zijn kwantitatiever dan andere. Aspecten op het gebied van rechtvaardigheid, wetgeving en volksgezondheid zijn vaak kwalitatiever en daarom opgenomen in het deel inzake waardebepaling van HTA in plaats van het evaluatieve deel.
- Beoogde patiëntenpopulatie: De specifieke populatie die voor dekking in aanmerking wordt genomen (bepaald door de volledig goedgekeurde indicatie of een subgroep daarbinnen).
- Ziektelast: Ook aangeduid als ‘onvervulde behoefte’ of ‘therapeutische behoefte’. Dit kan een maat zijn voor het aantal mensen met een bepaalde ziekte voor wie huidige behandelingen ontoereikend zijn. Het kan de hoeveelheid nieuwe diagnoses omvatten, of de kosten voor een samenleving of overheid die de mensen met de ziekte vertegenwoordigt. Het kan ook meer kwalitatieve aspecten bevatten over de ziektelast en behandelingen die op dit moment beschikbaar zijn voor patiënten.
- Beschrijving van het geneesmiddel: Een beschrijving van het geneesmiddel, hoe het werkt, afgiftemethode (bijv. injectie, pil), waar het wordt toegediend aan patiënten (bijv. ziekenhuis, gemeenschap, eerstelijnszorg, thuis), hoe vaak, en het toepasselijke gebruik ervan in de behandeling naast andere interventies en geneesmiddelen.
- Klinische werkzaamheid: In de geneeskunde duidt klinische werkzaamheid op een positief therapeutisch effect. Als werkzaamheid is vastgesteld, is een interventie waarschijnlijk minstens zo goed als andere beschikbare interventies waarmee deze is vergeleken.
Wanneer we het hebben over werkzaamheid versus effectiviteit, meet werkzaamheid hoe goed een behandeling werkt in klinische onderzoeken of laboratoriumstudies. Effectiviteit geeft daarentegen aan hoe goed een behandeling werkt in de medische praktijk. - Relatieve werkzaamheid: Dit is de mate waarin een interventie meer goed dan kwaad doet onder ideale omstandigheden vergeleken met een of meer alternatieve interventies.
- Klinische effectiviteit: Klinische effectiviteit is een maat waarmee wordt aangegeven hoe goed een bepaalde behandeling werkt in de medische praktijk. Het is afhankelijk van de toepassing van de beste kennis uit wetenschappelijk onderzoek, klinische ervaring en patiëntvoorkeuren.
- Relatieve klinische effectiviteit: Dit kan worden gedefinieerd als de mate waarin een interventie meer goed dan kwaad doet vergeleken met een of meer alternatieve interventies voor het bereiken van de gewenste resultaten wanneer toegediend onder normale praktijkomstandigheden in de gezondheidszorg.
- Economische evaluatie en kosten-effectiviteit: In de context van farmaco-economie wordt bij het bestuderen van kosten-effectiviteit gekeken naar de resultaten van verschillende interventies door een enkele uitkomst te meten, meestal in ‘natuurlijke’ eenheden (bijvoorbeeld gewonnen levensjaren, vermeden overlijdensgevallen, vermeden hartaanvallen of opgespoorde gevallen).
Vervolgens worden alternatieve interventies vergeleken in termen van kosten per (natuurlijke) effectiviteitseenheid om te beoordelen in hoeverre de interventie het geld waard is. Dit helpt besluitvormers te bepalen waar de gelimiteerde financiële middelen voor gezondheidszorg aan moeten worden besteed.
Kosten-effectiviteit is echter maar één van de criteria die moet worden gebruikt om te bepalen of interventies beschikbaar moeten worden gesteld. Andere zaken, zoals billijkheid, behoeften, gevolgen voor het dagelijks leven en prioriteiten van de patiënt moeten ook deel uitmaken van de economische evaluatie. - Impact op budget: De kosten binnen een bepaald tijdskader en gerelateerd aan een specifiek gezondheidszorgbudget in plaats van het totale budget van een land. Dit veronderstelt deugdelijke gegevens over epidemiologie en behandelpatronen, naast aannames over acceptatie en vervanging van huidige behandelingen.
- Innovatieve kenmerken: Een beoordeling of het gebruik van het geneesmiddel meer voordelen oplevert dan klinische meerwaarde (zoals gemak voor patiënten van, bijvoorbeeld, een andere afgiftemethode, of andere kenmerken die therapietrouw kunnen verbeteren, met daaruit voortvloeiende verbeteringen in klinische uitkomsten en/of kwaliteit van leven).
- Beschikbaarheid van therapeutische alternatieven: Een beschrijving van wat er nog meer beschikbaar is voor de behandeling van de ziekte. Dit kan al of niet een ander geneesmiddel zijn.
- Billijkheidsoverwegingen: Een beoordeling van hoe aanvaarding van de nieuwe therapie invloed kan hebben op maatstaven van eerlijkheid binnen het gezondheidsstelsel. Zal de therapie bijvoorbeeld leiden tot meer voordelen voor mensen die maatschappelijk of economisch achtergesteld zijn?
- Impact op volksgezondheid: Een onderzoek naar hoe de nieuwe therapie een bredere impact kan hebben op de volksgezondheid. Een nieuwe therapie voor de behandeling van HIV/AIDS kan bijvoorbeeld de overdracht van HIV in een gemeenschap verlagen.
De meeste HTA-instanties hebben richtlijnen voor bedrijven ontwikkeld om dit proces consistent te maken en eerlijke vergelijkingen te creëren. Maar richtlijnen verschillen van land tot land. Ze zijn te raadplegen op de websites van de meeste HTA-instanties en kunnen nader uitleg geven over hoe besluiten over nieuwe geneesmiddelen worden genomen.
Dossiers worden door HTA-instanties ofwel rechtstreeks ofwel met behulp van academische partners kritisch bestudeerd. Sommige HTA-instanties voeren onafhankelijke evaluaties van de klinische en economische bewijzen uit om conflicterende belangen te verminderen.
HTA: Waardebepaling
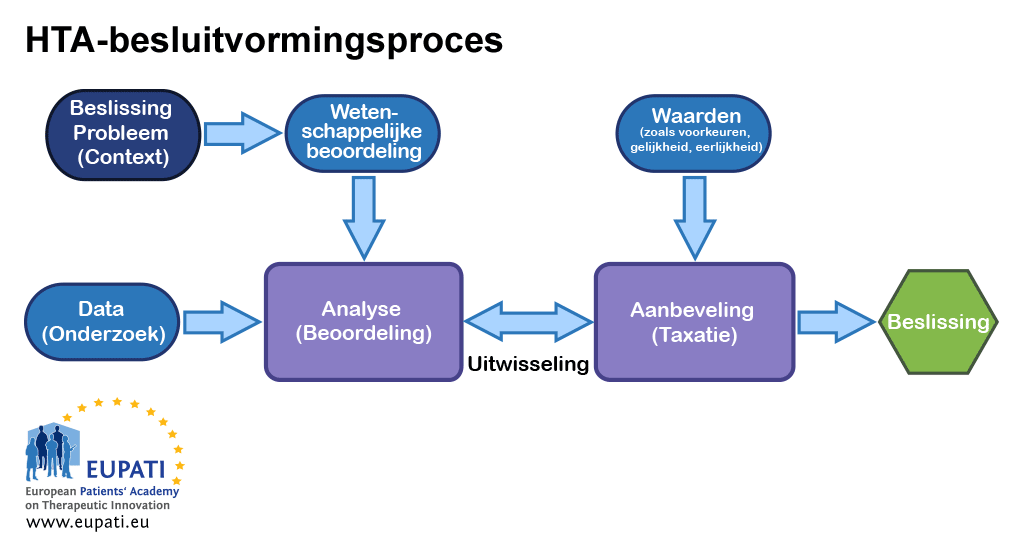
Omdat de besluitvorming over vergoeding van een nieuwe gezondheidstechnologie controversieel kan zijn, is het de ‘best practice’-benadering om de beoordeling van bewijs te scheiden van de toekenning van de waarde ervan en ook van de besluitvorming. Meestal baseren de instanties die een waardebepaling uitvoeren hun aanbevelingen op de uitkomst van de beoordeling van het bewijsmateriaal evenals op aanvullingen, zoals lokaal gezondheidsbeleid, waarden, en verhalen van patiënten.
HTA-procedures resulteren doorgaans in een besluit om de nieuwe technologie wel of niet op te nemen voor vergoeding in een op verzekering gebaseerd systeem (in het geneesmiddelenvergoedingssysteem zijn geneeskundige producten opgenomen die worden vergoed vanuit een basisverzekering) of in een aanbeveling voor gebruik ervan in een op waardebepaling gebaseerde nationale gezondheidsdienst. Dit kan gaan om opname in het geneesmiddelenvergoedingssysteem/aanbeveling voor gebruik van het geneesmiddel onder beperkte omstandigheden, bijvoorbeeld voor een kleinere groep patiënten met een ernstigere ziekte.
- Er zijn diverse inputs van belang op verschillende momenten in het besluitvormingsproces van HTA.
Om te bepalen of een interventie het percentage hartaanvallen vermindert, significante bijwerkingen veroorzaakt of kosten verhoogt, moet een oordeel gevormd worden over de deugdelijkheid van het bewijs. Er zijn altijd onzekerheden in het bewijs. Het is natuurlijk in het belang van elke HTA-instantie om gebruik te maken van degelijk wetenschappelijk oordeel en consistente, transparante methoden die leiden tot verdedigbare besluiten. Gezien de multidisciplinaire aard van HTA zijn de beste epidemiologische, sociologische, economische, ethische, rechtskundige en meer methoden nodig om de diverse analyses te ondersteunen.
Het nemen van een besluit vereist echter erkenning van wat de samenleving (en dus ook patiënten) belangrijk vinden. Is het iets goeds om het percentage hartaanvallen te verlagen? Tot welke prijs?
Goede waardebepalingen behelzen meerdere perspectieven en kunnen dus niet afdoende worden uitgevoerd door één enkel individu. Daarom wordt een commissie samengesteld die gebruikmaakt van een duidelijke en transparante procedure om tot een aanbeveling te komen. Deze procedure wordt vaak aangeduid als beraadslaagde waardebepaling. De meeste HTA-instanties leggen meer nadruk op de omvang van (en bewijskracht voor) voordelen in voor patiënten relevante gezondheidsuitkomsten die zijn waargenomen in goed opgezette klinische onderzoeken met toepasselijke vergelijkingsmiddelen.
De volgende stap (in termen van belangrijkheid) wordt vaak gevormd door een of meer economische overwegingen. Bijna alle HTA-bureaus nemen impact op het budget mee in hun overwegingen (het totale bedrag dat gebruik van het nieuwe geneesmiddel zal toevoegen aan de begroting voor het gezondheidsstelsel gedurende een gedefinieerde periode). Dit moet een netto begrotingscijfer zijn: waarin de besparingen zijn afgetrokken die elders in het gezondheidsstelsel kunnen optreden als gevolg van de voordelen die het nieuwe geneesmiddel met zich meebrengt (bijvoorbeeld minder ziekenhuisopnamen vanwege ernstige bijwerkingen). De neutraliteit van de commissiestructuur moet gewaarborgd zijn – met andere woorden, commissieleden moeten eventuele conflicterende belangen formeel aangeven of afzien van deelname.
Sommige HTA-instanties hebben een ethisch kader ingesteld wat evaluatie van hun aanbevelingen door een grotere groep betrokkenen mogelijk maakt. Zo kunnen bedrijven, artsen of patiënten die wellicht onterecht worden getroffen door een zwakke, vertekende of onnauwkeurige aanbeveling, bezwaar aantekenen.
In zeldzame gevallen vragen HTA-instanties de mening van burgers over lastige aspecten in de besluitvorming als het gaat om het stellen van prioriteiten in de gezondheidszorg. Zo heeft het Britse NICE een burgerraad die met behulp van een burgerjury meningen vormt over maatschappelijke waarden, die de NICE-commissies vervolgens kunnen meenemen in hun waardebepalingen. In de onderstaande lijst worden enkele kwesties vermeld waar de burgerraad over heeft geadviseerd.
| Jaar | Onderwerp |
|---|---|
| 2002 | Klinische behoefte |
| 2003 | Leeftijd en kosten-effectiviteit |
| 2004 | Geneesmiddelen voor zeer zeldzame ziekten en kosten-effectiviteit |
| 2005 | Verplichte volksgezondheidsmaatregelen |
| 2006 | Gebruik van de reddingsregel |
| 2007 | Patiëntveiligheid en kosten-effectiviteit |
| 2008 | Afwijkingen van de ICER-drempelwaarde |
| 2009 | Innovatie |
| 2010 | Gezondheidsverbetering en financiële prikkels |
| 2011 | Verdiscontering van kosten en baten |
| 2012 | Waarden maatschappelijke zorg |
In sommige gevallen worden HTA-uitkomsten gekoppeld aan prijsonderhandelingen. Onderhandelen over de prijs is een mechanisme voor overheden om toegang tot nieuwe behandelingen mogelijk te maken (dat wil zeggen, een manier vinden om niet ‘nee’ te zeggen). Andere variabelen zijn onder meer beperkingen in wie in aanmerking komen voor vergoeding van de behandeling.
Verder dan aanbevelingen
Aanbevelingen over het al dan niet beschikbaar maken van een nieuw geneesmiddel binnen een gezondheidszorgstelsel kunnen worden gezien als te rigide en niet flexibel genoeg door degenen die toegang tot nieuwe behandelingen nodig hebben. Omdat deze aanbevelingen gericht zijn op de algemene bevolking, bieden ze niet altijd ruimte voor uitzonderingen op individuele basis. In plaats van een ja/nee-aanbeveling, zijn andere mechanismen in HTA toegepast die wellicht nuttiger zijn.
- Dekking met ontwikkeling van bewijs: Dit kan worden gebruikt om toegang mogelijk te maken tot een veelbelovend nieuw geneesmiddel, waarvoor op het moment onvoldoende gegevens zijn ter ondersteuning van klinische effectiviteit en/of zijn kosten-effectiviteit. Onder deze omstandigheden kan HTA gebruik van het geneesmiddel aanbevelen, mits er een formele inzameling van bewijzen plaatsvindt om de onzekerheden op te lossen tijdens het gebruik, bijvoorbeeld in een register. Ook kunnen er klinische onderzoeken lopen die vanuit toezichthoudende instanties zijn opgelegd en die op een moment in de toekomst meer bewijs zullen leveren.
- Prijsbepaling: De prijs van een gezondheidstechnologie kan een direct effect hebben op de toegang van aanbieders en patiënten tot die technologie. In sommige gevallen kunnen betalers onderhandelen met het bedrijf over een prijs op basis van de toegekende waarde van de gezondheidstechnologie, met name wanneer de gezondheidstechnologie nuttig is in sommige maar niet in alle gevallen. Deze benadering waarborgt toegang tot een bepaalde technologie voor die aanbieders en patiënten die deze technologie ook nodig hebben. Er kunnen wel of geen HTA-instanties bij dit proces betrokken zijn. Maar een op waarde gebaseerde prijsstelling brengt ook uitdagingen met zich mee, omdat het moeilijk is om ervoor te zorgen dat alle aspecten van de waarde van een gezondheidstechnologie in voldoende mate aan de orde komen. Zo kan het zijn dat de resultaten van kortdurende klinische onderzoeken geen productkenmerken geven die voor patiënten van belang zijn, zoals gemak van doseringsschema’s of minder invasieve afgiftemethoden.
- Keuzehulpmiddelen en klinische richtlijnen: De HTA kan aangeven dat het geneesmiddel de meeste waarde heeft wanneer het wordt gebruikt bij een bepaalde groep patiënten of in een bepaalde reeks na andere behandelopties. Om de waarde te optimaliseren kan de betaler besluiten om vergoeding van het geneesmiddel te verbinden aan specifieke klinische richtlijnen (voor voorschrijvers) of specifieke keuzehulpmiddelen (voor patiënten en artsen). Keuzehulpmiddelen zijn hulpmiddelen voor patiënten en artsen om bewijs te gebruiken als informatie bij een individuele beslissing. Ze helpen patiënten te kiezen tussen twee behandelingen die verschillende risico’s en voordelen hebben. Dit stelt hen in staat beter geïnformeerd gesprekken te voeren met hun artsen over wat ze het belangrijkst vinden en te bepalen wat de beste optie voor hen is.1
- Prioriteitsstelling en budgetten in gezondheidsstelsels: In de loop van de tijd zijn manieren gevonden om HTA-informatie te gebruiken om te bepalen voor welke diensten moet worden betaald (bijv. om te bepalen welke diensten moeten worden opgenomen in een universele zorgverzekering). Oftewel, wat is de optimale mix die waarde oplevert en haalbaar is voor de betaler.2
HTA-netwerken
Veel HTA-organisaties in Europa zijn ook met elkaar verbonden via het European Union Network of HTA organisations (EUnetHTA), dat in 2004 werd opgericht. EUnetHTA werkt nauw samen met de Europese Commissie, het Europees Geneesmiddelenbureau (EMA) en belangenorganisaties die patiënten/consumenten, de industrie, betalers (verzekeraars) en zorgverleners vertegenwoordigen. EUnetHTA werkt aan de ontwikkeling van methoden, standaarden en procedures van het netwerk voor HTA in Europa (HTA-netwerk).
Het HTA-netwerk gaat zich inzetten voor goede HTA-praktijken en -methoden in reactie op de hoge mate aan diversiteit in de Europese methoden, handelswijzen en uitkomsten evenals het vele dubbele werk dat wordt verricht op het gebied van HTA. Het gaat ook efficiënt gebruik van HTA-middelen in Europa bevorderen. Sleutelactiviteiten die het EUnetHTA onderneemt zijn onder meer de ontwikkeling van richtlijnen voor HTA-methodologie en experimenteren met gezamenlijke beoordeling van relatieve effectiviteit. Deze activiteiten zullen helpen de werkdruk op nationaal niveau te verminderen en het gemakkelijker maken voor HTA-instanties op het niveau van de lidstaten om de aanvullende analyses uit te voeren en besluiten te nemen die specifiek van toepassing zijn voor hun gezondheidsstelsel.
Overige informatiebronnen
- Health Technology Assessment Network. Geraadpleegd op 6 januari 2016 op https://ec.europa.eu/health/technology_assessment/policy/network
- EUnetHTA: http://www.eunethta.eu/ (Geraadpleegd op 6 januari 2016)
- Opportunities for patients to be involved with EUnetHTA: http://www.eunethta.eu/ (Geraadpleegd op 6 januari 2016).
- Sorenson, C., Drummond, M., and Panos, K. (2008). Ensuring value for money in health care: The role of health technology assessment in the European Union. Kopenhagen: World Health Organization. Geraadpleegd op 6 januari 2016 op http://www.euro.who.int/__data/assets/pdf_file/0011/98291/E91271.pdf
- Velasco Garrido, M., Kristensen, F.B., Nielsen, C.P, and Busse, R. (2008). Health technology assessment and health policy-making in Europe: Current status, challenges and potential. Kopenhagen: World Health Organization. Geraadpleegd op 6 januari 2016 op http://www.euro.who.int/__data/assets/pdf_file/0003/90426/E91922.pdf
- Kleinjen, S., George, E., Goulden, S., et al. (2012). ‘Relative effectiveness assessment of pharmaceuticals: similarities and differences in 29 jurisdictions’. Value Health, (15), 954-960. Geraadpleegd op 6 januari 2016 op http://www.valueinhealthjournal.com/article/S1098-3015(12)01609-9/pdf
- Rawlins, M. (2014). ‘Evidence, values, and decision-making.’ International Journal of Technology Assessment in Health Care, (30), 233-238.
Referenties
- Ottawa Hospital Research Institute (2014). Patient Decision Aids: Implementation Toolkit. Geraadpleegd op 6 januari 2016 op http://decisionaid.ohri.ca/implement.html
- Bandolier (2007). Programme budgeting and marginal analysis. Geraadpleegd op 6 januari 2016 op http://www.bandolier.org.uk/booth/glossary/PBMA.html
A2-6.05-v1.1