Last update: 13 января 2016
Введение
Медицинско-технологическая оценка (МТО) — это мультидисциплинарный процесс, который обобщает информацию о медицинских, социальных, экономических и этических аспектах, связанных с использованием медицинских технологий, с помощью систематических, понятных, объективных и надежных методов. Его цель — ознакомление с формированием безопасных и эффективных направлений политики в области здравоохранения, направленных на пациента, и поиск способов достижения оптимальной стоимости. Несмотря на политические цели, МТО должна всегда твердо основываться на научно-исследовательских методах.
Если рассматривать МТО в рамках оценки лекарственных препаратов, полезно ознакомиться с процессом регистрации лекарственных препаратов и иметь общее представление о жизненном цикле препарата и процессах, которые приводят к получению регистрационного свидетельства (РС). Кроме того, полезно узнать, какое место занимает МТО в схемах компенсационных выплат или страхового обеспечения в зависимости от страны. Фармацевтическая компания должна проводить высококачественные рандомизированные клинические исследования и подавать регистрационное досье в соответствующие регуляторные органы. После получения для продукции регистрационного свидетельства на основании данных по безопасности, качеству и эффективности эта продукция может представляться на рынке (может продаваться). Чтобы гарантировать общедоступность необходимых видов лечения для пациентов, часто необходимо, чтобы национальная система здравоохранения или страхование покрывали такое лечение. Это означает, что препарат может быть включен в соответствующий национальный перечень лекарственных препаратов для компенсации или для него может быть предусмотрено страховое покрытие.
В то же время эти учреждения-плательщики должны быть способны обеспечить доступ к инновационным методам лечения в рамках ограниченного бюджета. Вследствие этих ограничений плательщики хотят убедиться, что они платят за новые технологии, которыйе обеспечивают достоверное улучшение исходов у пациента. И тогда выступает на первый план МТО, поскольку ее основная функция — определение дополнительной терапевтической ценности (с учетом исходов для здоровья пациентов) новой технологии по сравнению с текущими стандартами медицинского обслуживания.
Для начала стоит понять, какие организации являются основными действующими лицами в этом процессе. В Европе существуют различные органы, ответственные за фармацевтическую и нефармацевтическую медицинско-технологическую оценку (МТО). Структура, функция, сферы деятельности и подходы этих органов отличаются в зависимости от систем здравоохранения и политических структур, в условиях которых они функционируют.
Ниже представлены отдельные примеры органов МТО для проведения фармацевтической оценки в Европе:
- Франция — Высший совет здравоохранения (HAS), Франция — http://www.has-sante.fr
- Германия — Комиссия Министерства здравоохранения Российской Федерации по формированию перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи (GBA) — https://www.g-ba.de/
- Шотландия — Шотландский консорциум по лекарственным средствам (SMC) — scottishmedicines.org.uk/Home
- Швеция — Tåndvards Och Läkemedelsförmänsverket (TLV) — tlv.se/In-English/in-english/
Обратите внимание, что в Германии компонент МТО, связанный с оценкой, проводится IQWIG (Институт качества и эффективности в сфере здравоохранения), тогда как за экспертизу и принятие решения отвечает GBA. Кроме того, обратите внимание, что в некоторых странах Европы орган МТО также проводит оценку нефармакологических средств, таких как устройства, хирургические процедуры и (в некоторых случаях) вмешательств в сфере общественного здравоохранения. К ним относятся:
- Норвегия — NOKC (Норвежский центр знаний, Nasjonalt kunnskapssenter for helsetjenesten) — https://www.fhi.no/en/
- Швеция — SBU (Шведское управления медицинско-технологической оценки и оценки социальных услуг) — http://www.sbu.se/en/
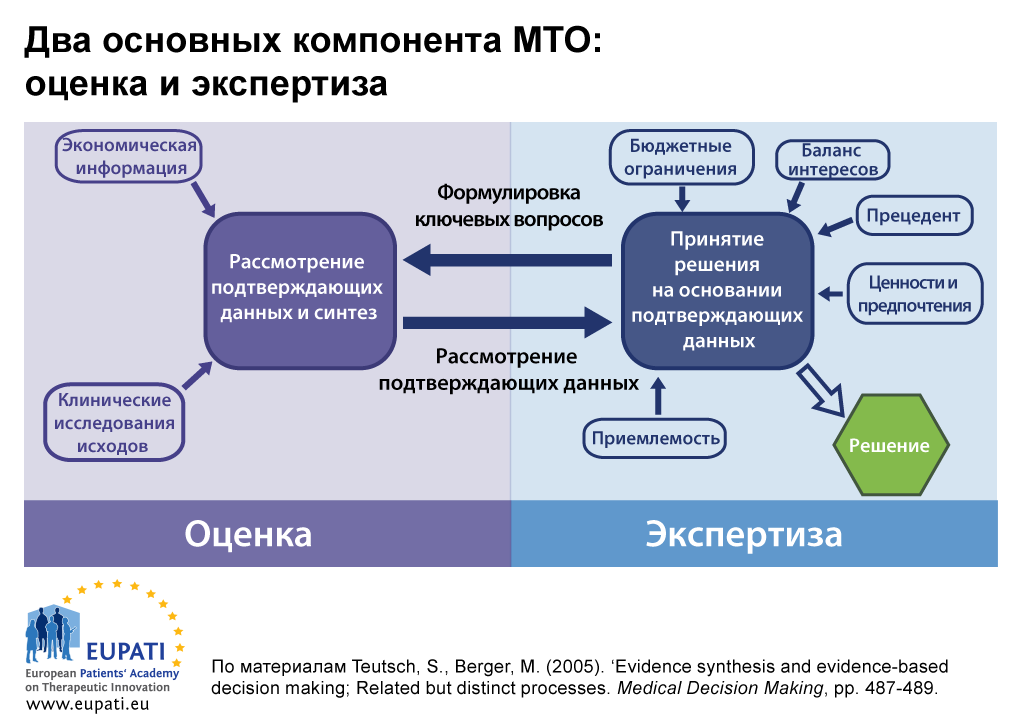
МТО состоит из двух основных компонентов: оценка и экспертиза.
В некоторых странах функции МТО по оценке и экспертизе могут проводить два отдельных органа.
- В обязанности одного органа входит проведение оценки — синтез подтверждающих данных или критическое рассмотрение представленных доказательств.
- Совсем другой орган может выполнять экспертизу — рассмотрение результатов оценки с учетом более масштабных факторов, связанных с местным контекстом. Затем предоставляются рекомендации или консультации.
МТО: Оценка
Процесс МТО, касающийся лекарственных препаратов, обычно начинается при подаче компанией в орган МТО досье с соответствующей информацией. Для других средств (не лекарственных препаратов) органы МТО обычно проводят систематический обзор опубликованной информации. По умолчанию досье содержит подробные сведения о безопасности и эффективности новой технологии, а также о «дополнительных клинических преимуществах» — то есть, сравнение клинической эффективности нового препарата с существующим стандартным медицинским обслуживанием (средство сравнения).
Некоторые системы МТО в Европе также оценивают возможное влияние новой продукции на бюджет системы здравоохранения (оценка влияния на бюджет) или эффективность лекарственного препарата по сравнению с затратами на него в данной системе (например, анализ экономической эффективности или экономическая оценка). Не все системы МТО в Европе обращают одинаковое внимание на сравнительный анализ экономической эффективности, однако все ориентируются на дополнительные клинические преимущества.
Наиболее распространенные компоненты регистрационного досье или «заявки» изложены ниже: обратите внимание, что некоторые из этих компонентов являются более количественными по сравнению с остальными. Баланс интересов, правовые аспекты и аспекты, связанные с общественным здравоохранением, могут быть более качественными, и поэтому они скорее могут содержаться в части МТО, посвященной экспертизе, чем в оценочной части.
- Целевая группа пациентов: отдельная группа, которую предполагается охватить (определяется с учетом всего зарегистрированного показания или подгруппы в его рамках).
- Бремя заболевания: также называется «неудовлетворенная потребность» или «терапевтическая потребность». Его можно оценить на основании количества людей, болеющих определенным заболеванием, для которых на сегодняшний день отсутствует эффективное лечение. Это может включать количество впервые диагностированных случаев заболевания или затраты общественности либо государства на людей с данной болезнью. Кроме того, могут учитываться более качественные аспекты, связанные с бременем заболевания и доступным на сегодняшний день лечением пациентов.
- Описание лекарственного препарата: описание лекарственного препарата, его действия, способа доставки (например, инъекция, таблетка), место применения его пациентами (например, в стационаре, неспециализированных учреждениях, в поликлинике, дома), частота применения и его надлежащее применение в рамках лечения вместе с другими вмешательствами и лекарственными препаратами.
- Клиническая результативность: в медицине клиническая результативность означает положительный терапевтический эффект. Если результативность установлена, вмешательство, вероятно, по крайней мере такое же эффективное, как и другие доступные вмешательства, с которыми оно сравнивалось.Что касается терминов «результативность» и «эффективность», то результативность показывает, насколько хорошо действует лечение в рамках клинических или лабораторных исследований. Эффективность же, с другой стороны, демонстрирует, насколько хорошо лечение действует на практике.
- Относительная результативность: она показывает, насколько вмешательство более полезно, чем вредно, при идеальных условиях по сравнению с одним или более альтернативных вмешательств.
- Клиническая эффективность: клиническая эффективность — это показатель эффективности определенного лечения в практической медицине. Она зависит от применения всех доступных знаний, полученных во время исследований, клинического опыта и учета предпочтений пациента.
- Относительная клиническая эффективность: согласно определению она показывает, насколько вмешательство более полезно, чем вредно, по сравнению с одним или более альтернативных вмешательств для достижения желаемых результатов в случае применения в обычных условиях медицинской практики.
- Экономическая оценка и экономическая эффективность: в рамках фармакоэкономики экономическая эффективность изучается с помощью рассмотрения результатов разных вмешательств с учетом оценки одного исхода, обычно в «естественных» единицах (например, увеличение продолжительности жизни в годах, количество предотвращенных смертельных случаев, количество предотвращенных сердечных приступов или зарегистрированные случаи).Затем альтернативные вмешательства сравниваются с учетом затрат на одну (естественную) единицу эффективности, чтобы оценить ценность с экономической стороны. Это помогает лицам, принимающим решение, определить, куда направить ограниченные ресурсы в области здравоохранения.Однако экономическая эффективность — это лишь один из ряда критериев, которые должны использоваться для того, чтобы определить, станет ли вмешательство доступным. Другие аспекты, например баланс интересов, потребности, влияние на работоспособность и приоритеты пациента, также должны учитываться в рамках экономической оценки.
- Влияние на бюджет: расходы в рамках определенного временного промежутка, связанные скорее с определенным бюджетом в сфере здравоохранения, чем с общим бюджетом страны. Это предполагает оценку достоверных эпидемиологических данных и схем лечения наряду с предположениями относительно внедрения и замены текущих видов лечения.
- Инновационные характеристики: оценка того, существуют ли преимущества применения данного лекарственного препарата, помимо дополнительных клинических преимуществ (таких как, удобство для пациентов, например в виде другого способа доставки, либо другие характеристики, которые могут улучшить соблюдение условий терапии, что приводит к улучшению клинических исходов и/или качества жизни).
- Доступность терапевтических альтернатив: описание других доступных средств для лечения заболевания. Это необязательно должен быть другой лекарственный препарат.
- Соображения, касающиеся баланса интересов: оценка того, насколько внедрение новой терапии будет сохранять справедливость в сфере здравоохранения. Например, имеет ли терапия больше преимуществ для социально незащищенных людей или неимущих?
- Влияние на общественное здравоохранение: изучение возможного более масштабного влияния новой терапии на общественное здравоохранение. Например, новая терапия для лечения ВИЧ/СПИДа может снизить частоту передачи ВИЧ в обществе.
Большинство органов МТО разработали руководства для компаний, чтобы сделать данный процесс унифицированным и проводить справедливые сравнения. Однако эти руководства в разных странах различаются, и они доступны на веб-сайтах большинства органов МТО и могут помочь понять, как принимаются решения по лекарственным препаратам.
Изучение досье проводят либо непосредственно органы МТО, либо аффилированные научные организации. Некоторые органы МТО проводят независимую оценку клинических и экономических данных, чтобы снизить вероятность конфликта интересов.
МТО: Экспертиза
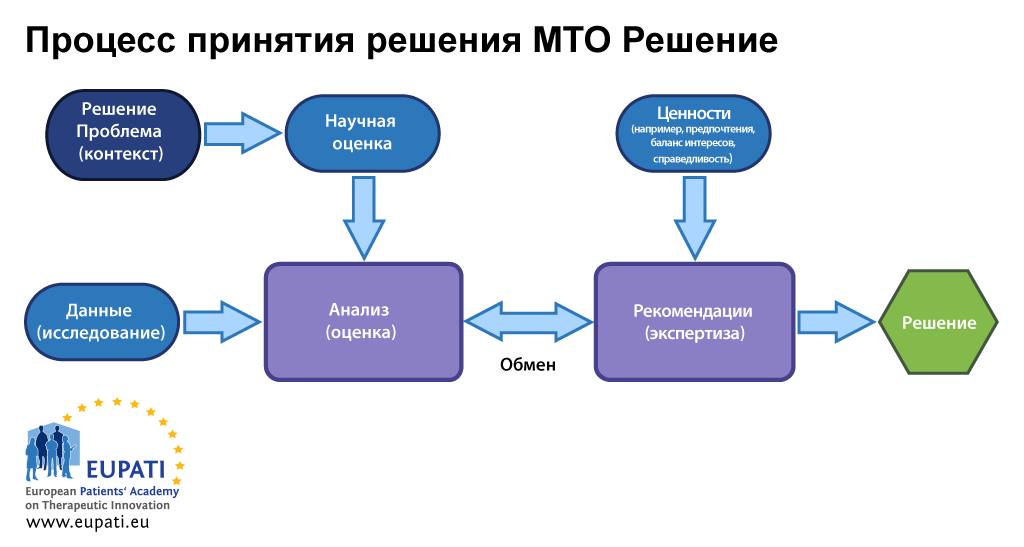
Поскольку принятие решения относительно возмещения расходов на новую медицинскую технологию может быть противоречивым, наилучшим практическим подходом считается оценка подтверждающих данных отдельно от экспертизы, а также от принятия решения. Обычно рекомендации органов, которые проводят экспертизу, основываются на результате оценки подтверждающих данных, а также на дополнительных аспектах, например местной политике в сфере здравоохранения, ценностях и заявлениях пациентов.
Процессы МТО в основном приводят к принятию решения относительно включения или не включения новой технологии в список для возмещения расходов в системе, основанной на страховании (список содержит лекарственные препараты для возмещения расходов в рамках государственного медицинского страхования) или рекомендации его для применения в рамках национальной системы здравоохранения с установленными тарифами. Лекарственный препарат могут включать в список/рекомендовать для применения при ограниченных условиях, например для меньших групп пациентов с более тяжелым заболеванием.
- Взаимосвязи между оценкой и экспертизой влияют на принятие решения в рамках медицинско-технологической оценки (МТО).
- В процессе принятия решения в рамках МТО в разные моменты времени важны различные исходные данные.
Для того чтобы определить, снижает ли вмешательство частоту возникновения сердечных приступов, вызывает ли оно существенные побочные эффекты и повышает ли оно расходы, необходимо оценить надежность подтверждающих данных. В подтверждающих данных всегда существует неопределенность. Вне всякого сомнения для любого органа МТО лучше всего проводить тщательную научную оценку и применять унифицированные и понятные подходы, которые приводят к принятию обоснованных решений. Учитывая мультидисциплинарный характер МТО необходимо использовать наилучшие эпидемиологические, социологические, экономические, этические, правовые и другие подходы для проведения разнообразных анализов.
Принятие решения, однако, требует понимания ценностей общества и пациентов. Хорошее ли это средство для снижения частоты возникновения сердечных приступов? Какой ценой?
Надлежащие подходы к экспертизе предусматривают рассмотрение многих точек зрения, и поэтому они не могут удовлетворительно выполнятся одним человеком. По этой причине заседает комитет, который использует четкий и понятные процесс для подготовки рекомендаций. Часто этот процесс называется «совещательная экспертиза». Большинство органов МТО большое значение уделяет степени (и силе доказательств) улучшения важных для пациента исходов для здоровья, которая наблюдалась в хорошо продуманных клинических исследованиях с соответствующими препаратами сравнения.
Наиболее важным следующим аспектом является одно или более экономических соображений. Почти все органы МТО учитывают влияние на бюджет (общая сумма, которую необходимо прибавить к бюджету системы здравоохранения вследствие применения нового лекарственного препарата в течение определенного периода). Это должен быть бюджет-нетто: бюджет с вычетом средств, возможно сэкономленных в других областях системы здравоохранения вследствие преимуществ, связанных с новым лекарственным препаратом (например, меньшее количество госпитализаций вследствие тяжелых нежелательных явлений). Должен обеспечиваться нейтралитет структуры комитета — другими словами, члены комитета должны официально заявить о возможном конфликте интересов или отказаться от участия.
Некоторые органы МТО заимствовали этическую концепцию, которая позволяет более широкому кругу заинтересованных сторон рассматривать их рекомендации. Это позволяет привлекать компании, клиницистов или пациентов, которые могут несправедливо пострадать вследствие предоставления ошибочных, предвзятых или неточных рекомендаций.
Изредка органы МТО хотят узнать мнение сограждан относительно проблемных аспектов принятия решений во время определения приоритетов в области здравоохранения. Например, в Великобритании в состав NICE входит Гражданский совет, который использует подход с участием гражданского жюри для получения суждений по социальным ценностям. Этот совет может предоставлять информацию экспертным комитетам NICE. Ниже перечислены некоторые вопросы, по которым консультирует Гражданский совет.
| Год | Тема |
|---|---|
| 2002 | Клиническая потребность |
| 2003 | Возраст и экономическая эффективность |
| 2004 | Ультраорфанные препараты и экономическая эффективность |
| 2005 | Обязательные меры в области общественного здравоохранения |
| 2006 | Использование правила спасения |
| 2007 | Безопасность пациента и экономическая эффективность |
| 2008 | Отклонение от пороговых значений ICER |
| 2009 | Инновация |
| 2010 | Улучшение состояния здоровья и материальные стимулы |
| 2011 | Пренебрежение расходами и преимуществами |
| 2012 | Ценности при оказании социальной помощи |
В некоторых случаях результаты МТО будут связаны с переговорами о ценах. Договорная цена — это один из механизмов, за счет которого правительство может обеспечить доступ в новым видам терапии (то есть, найти способ не отказывать). Другие возможности могут включать ограничения относительно того, кто может получать лечение с использованием механизмов возмещения расходов.
За рамками рекомендаций
Рекомендации относительно возможности получения нового лекарственного препарата в рамках системы здравоохранения можно считать слишком строгими без обеспечения гибких подходов для тех, кому требуется новая терапия. Поскольку такие рекомендации обычно даются с учетом популяции, они могут не охватывать исключения для каждого отдельного случая. Вместо рекомендаций «да/нет» МТО задействовала другие механизмы, которые могут быть более полезными.
- Охватывание разработкой подтверждающих данных (CED): это можно использовать для разрешения доступа к многообещающему новому лекарственному препарату, для которого в данное время нет достаточно данных, подтверждающих его клиническую или экономическую эффективность. В таких условиях МТО может рекомендовать применение лекарственного препарата, что обеспечивает формальное получение подтверждающих данных для разрешения сомнений во время его применения, например в рамках реестра. С другой стороны регуляторные органы могут потребовать проведения клинических исследований, в которых можно получить дополнительные подтверждающие данные в определенный момент в будущем.
- Определение цены: цена медицинской технологии может непосредственно влиять на поставщика и доступ пациентов к данной технологии. В некоторых случаях плательщики могут вести переговоры с компанией относительно цены на основании субъективной стоимости медицинской технологии, особенно если применение этой медицинской технологии полезно в некоторых, а не во всех случаях. Этот подход гарантирует, что эти поставщики и пациенты, которым требуется определенная технология, имеют к ней доступ. Органы МТО не обязательно участвуют в данном процессе. Однако определение цены на основании стоимости представляет определенные трудности, поскольку тяжело гарантировать, что надлежащим образом учитываются все аспекты стоимости медицинской технологии. Например, результаты краткосрочных клинических исследований могут не продемонстрировать особенностей препарата, имеющих значение для пациентов, например удобство схемы дозирования или менее инвазивные способы применения.
- Вспомогательные средства для принятии решения и клинические руководства: МТО может свидетельствовать о том, что ценность лекарственного препарата больше в случае применения его в отдельной группе пациентов или в особых случаях после применения других вариантов лечения. Для оптимизации стоимости плательщики могут решить возмещать расходы на лекарственный препарат согласно отдельному клиническому руководству (для врачей, назначающих лечение) или отдельным вспомогательным средствам для принятия решения (для пациентов и клиницистов). Вспомогательные средства для принятия решения — это инструменты для пациентов и врачей, в которых используются подтверждающие данные, помогающие в принятии решения в каждом отдельном случае. Они помогают пациентам выбирать между двумя видами лечения с различными рисками и преимуществами. Это позволяет им быть более информированными во время обсуждения со своими врачами вопросов относительно того, что представляет для них наибольшую ценность, и определения наилучшего для себя варианта лечения.1
- Установка приоритетов системы здравоохранения и бюджеты: методы усовершенствовались, чтобы использовать информацию МТО для определения услуг, за которые необходимо заплатить (например, определение, какие услуги следует включить в универсальное медицинское обеспечение). Другими словами, какое существует оптимальное сочетание, обеспечивающее эффективность и являющееся допустимым для плательщика.2
Сети МТО
Многие организации МТО также связаны между собой Сетью организаций МТО Европейского Союза (EUnetHTA), созданной в 2004 г. EUnetHTA тесно сотрудничает с Комиссией ЕС, Европейским агентством по лекарственным средствам (EMA) и заинтересованными организациями, представляющими пациентов/потребителей, отрасль, плательщиков (обязательное медицинское страхование) и медицинских работников. Работа EUnetHTA связана с разработкой методов, стандартов и процессов сети для МТО в Европе (сеть МТО).
Сеть МТО будет способствовать применению надлежащей практики и методов МТО в условиях значительного разнообразия результатов, подходов и методов МТО в Европе, а также высокого уровня дублирования усилий. Ее целью также будет содействие эффективному использованию ресурсов МТО в Европе. Среди основных видов деятельности EUnetHTA, которые проводятся в рамках сети МТО, можно выделить разработку руководства по методологии МТО и апробирование совместной оценки относительной эффективности. Эти виды деятельности помогут снизить уровень нагрузки на национальном уровне и облегчить на уровне стран-участниц проведение органами МТО дополнительных анализов и принятие решений, специфичных для их системы здравоохранения.
Дополнительные источники
- Сеть для проведения медицинско-технологической оценки (МТО). Источник по состоянию на 6 января 2016 г.: https://ec.europa.eu/health/technology_assessment/policy/network
- EUnetHTA: http://www.eunethta.eu/ (Источник по состоянию на 6 января 2016 г.)
- Возможности для пациентов участия в EUnetHTA: http://www.eunethta.eu/ (Источник по состоянию на 6 января 2016 г.).
- Sorenson, C., Drummond, M., and Panos, K. (2008). Ensuring value for money in health care: The role of health technology assessment in the European Union. Копенгаген: Всемирная организация здравоохранения. Источник по состоянию на 6 января 2016 г.: http://www.euro.who.int/__data/assets/pdf_file/0011/98291/E91271.pdf
- Velasco Garrido, M., Kristensen, F.B., Nielsen, C.P, and Busse, R. (2008). Health technology assessment and health policy-making in Europe: Current status, challenges and potential. Копенгаген: Всемирная организация здравоохранения. Источник по состоянию на 6 января 2016 г.: http://www.euro.who.int/__data/assets/pdf_file/0003/90426/E91922.pdf
- Kleinjen, S., George, E., Goulden, S., et al. (2012). ‘Relative effectiveness assessment of pharmaceuticals: similarities and differences in 29 jurisdictions’. Value Health, (15), 954-960. Источник по состоянию на 6 января 2016 г.: http://www.valueinhealthjournal.com/article/S1098-3015(12)01609-9/pdf
- Rawlins, M. (2014). ‘Evidence, values, and decision-making.’ International Journal of Technology Assessment in Health Care, (30), 233-238.
Справочная литература
- Ottawa Hospital Research Institute (2014). Patient Decision Aids: Implementation Toolkit. Retrieved 6 January, 2016, from http://decisionaid.ohri.ca/implement.html
- Bandolier (2007). Programme budgeting and marginal analysis. Retrieved 6 January, 2016, from http://www.bandolier.org.uk/booth/glossary/PBMA.html
A2-6.05-v1.1