Last update: 26 września 2016
Czym jest wczesne stadium rozwoju klinicznego?
Wczesne stadium rozwoju klinicznego z reguły odnosi się do pierwszych badań leku z udziałem ludzi — określanych zazwyczaj jako badania Fazy I i Fazy II.
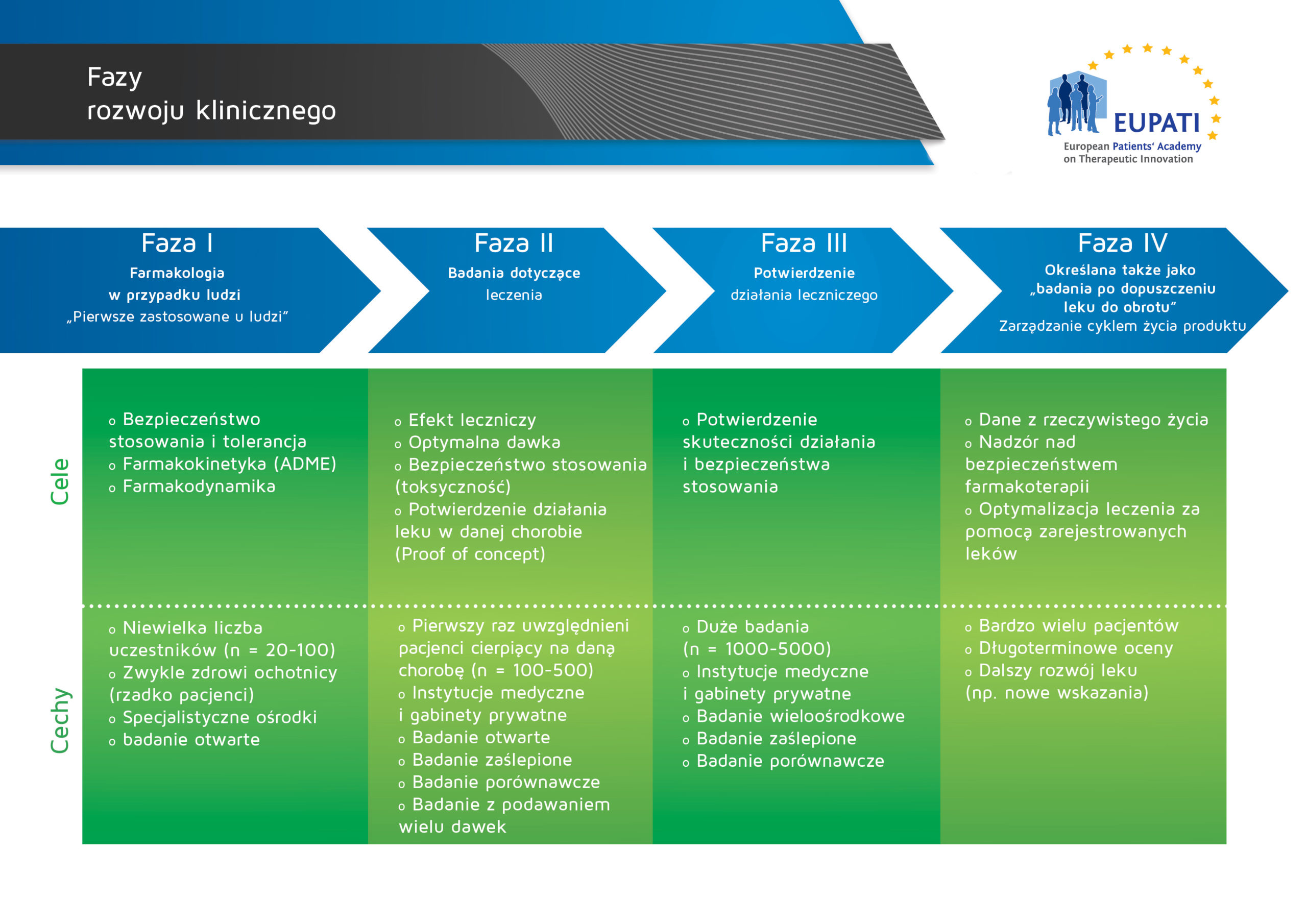
Etapy rozwoju klinicznego są zazwyczaj przedstawione jako kolejne fazy, jak na rysunku poniżej.
- Cele i cechy czterech faz rozwoju klinicznego są różne.
Logika stojąca za przedstawianiem opracowywania leków w serii kolejnych faz wynika z koncepcji mówiącej, że wyniki powinny wpływać na plany dalszych badań: otrzymane dane będą często inicjowały modyfikacje w strategiach rozwoju.
Jednak badania są również klasyfikowane w fazach w oparciu nie tylko o czas ich przeprowadzania, ale również ich cele. W niektórych przypadkach badania mogą łączyć kilka faz o różnych celach podstawowych.
Oznacza to, że w miarę postępowania rozwoju leku nowe dane sugerują potrzebę dodatkowych badań, które są typową częścią wcześniejszej fazy. Przykład: mimo że badania farmakologiczne z udziałem ludzi są zazwyczaj prowadzone w Fazie I, większość z tych badań jest również przeprowadzana w trakcie każdej kolejnej fazy (patrz diagram poniżej).
Jakie są cele wczesnego stadium rozwoju klinicznego?
Badania we wczesnym stadium rozwoju klinicznego są skupione na bezpieczeństwie i tolerancji nowego leku. Próbują również pokazać, że lek może działać w zamierzony sposób.
W trakcie wczesnego stadium rozwoju klinicznego należy odpowiedzieć na następujące pytania:
-
Faza I
- Czy lek jest bezpieczny dla ludzi? Na jakich poziomach? (Tolerancja)
- Jak organizm przetwarza lek? (Farmakokinetyka (PK))
- Jak lek działa w organizmie? (Farmakodynamika (PD))
- Jakie istnieją interakcje? (interakcje lek-lek, interakcje z żywnością i napojami itd.)
- Czy lek jest czynny?
-
Faza II
- Czy lek jest bezpieczny dla pacjentów? (Bezpieczeństwo stosowania)
- Jak lek działa w organizmie? (Farmakodynamika (PD))
- Czy lek wydaje się skuteczny u pacjentów? W jakiej dawce/dawkach? (Działanie)
- Jak powinny być zaprojektowane badania potwierdzające? (Punkty końcowe, populacja docelowa, inne przyjmowane leki (towarzyszące) itd.)
Jakie są wymogi we wczesnym stadium rozwoju klinicznego?
Przed rozpoczęciem wczesnego stadium rozwoju klinicznego leku dostępna musi być wystarczająca ilość danych na podstawie badań nieklinicznych potwierdzających bezpieczeństwo przy podawaniu leku ludziom. Następnie należy stworzyć plan rozwoju klinicznego, który:
- Ustala cele programu klinicznego.
- Określa wymogi, które należy spełnić w celu stwierdzenia pozytywnego Dowodu koncepcji.
- Opisuje budowę i sposób prowadzenia badań klinicznych Fazy I oraz Fazy II.
Jak podejmowane są decyzje we wczesnym stadium rozwoju klinicznego?
Decyzje dotyczące rozwoju są oparte na danych. Wyniki badań są uważnie analizowane przed kontynuowaniem dalszego rozwoju. Przed dalszym prowadzeniem rozwoju należy zdobyć Dowód koncepcji oraz wybrać harmonogram dawkowania. Jeżeli wstępne stadium rozwoju leku zakończy się wynikiem pozytywnym, wówczas badania leku mogą być kontynuowane. Niejasne wyniki we wczesnym stadium rozwoju wymagają dalszych testów i oceny przed podjęciem decyzji. Jeśli wczesne stadium rozwoju leku zakończy się wynikiem negatywnym — na przykład, jeżeli koncepcja zostanie niewystarczająco udowodniona lub w przypadku pojawienia się niedopuszczanych wyników odnośnie do bezpieczeństwa leku — wówczas rozwój zostaje zatrzymany. Jest to punkt, w którym zostaje zatrzymany rozwój dużej liczby leków.
A2-5.03.1-V1.1