Last update: 26 septembrie 2016
Ce este dezvoltarea clinică timpurie?
Dezvoltarea clinică timpurie se referă, în general, la primele studii ale unui medicament pe oameni – cunoscute de obicei sub numele de studii de fază I și fază II.
Etapele dezvoltării clinice sunt de obicei reprezentate ca faze consecutive, așa cum se arată în imaginea de mai jos:
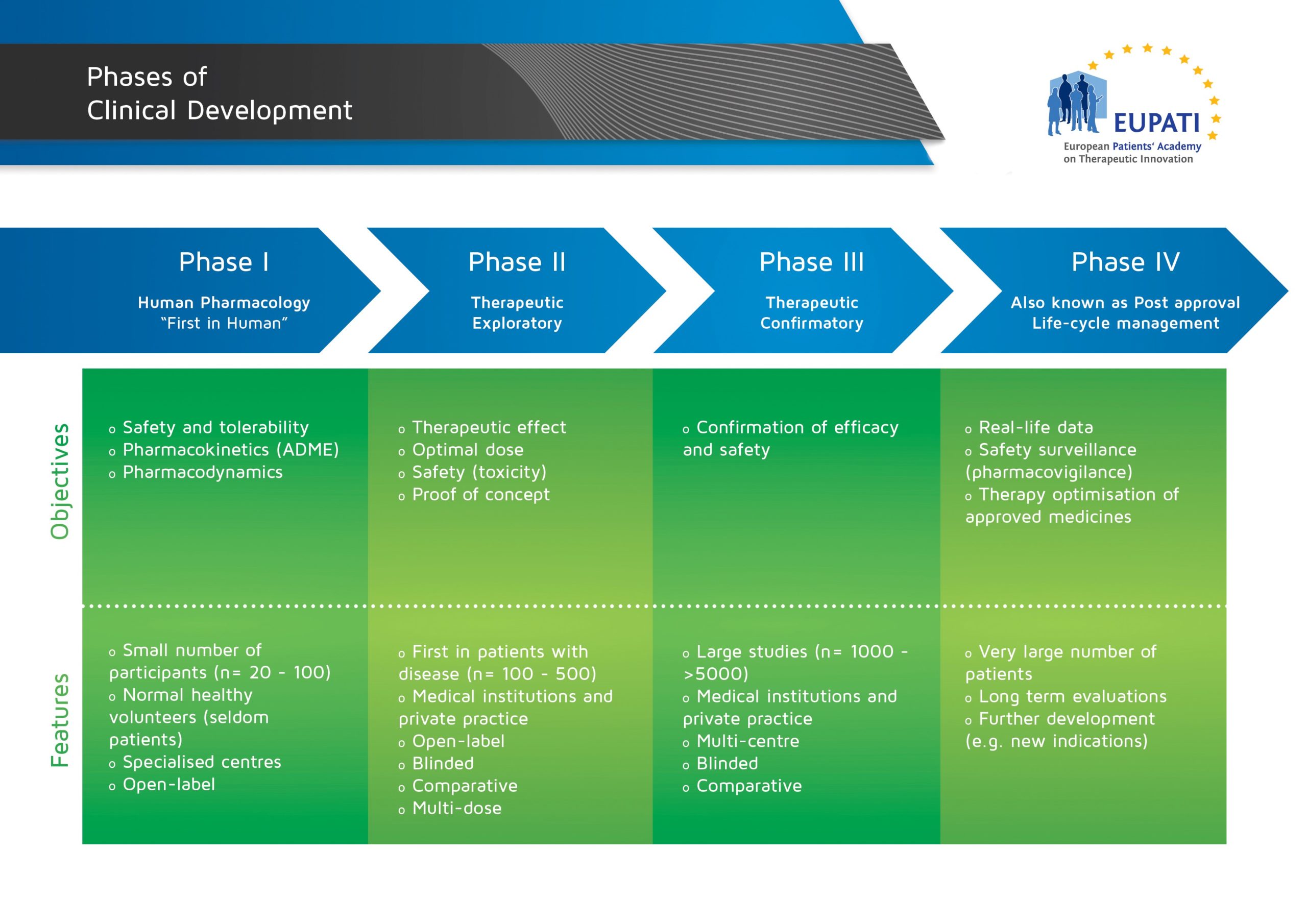
Cu toate acestea, studiile sunt, de asemenea, clasificate în faze nu doar în funcție de momentul în care au loc, ci și de obiectivele lor. În unele cazuri, studiile pot combina mai multe faze cu obiective fundamentale diferite.
Aceasta înseamnă că, pe măsură ce dezvoltarea unui medicament progresează, noile date pot sugera necesitatea unor studii suplimentare care fac parte, de obicei, dintr-o fază anterioară. De exemplu, deși studiile de farmacologie umană sunt efectuate de obicei în timpul fazei I, multe dintre aceste studii sunt efectuate și în timpul fiecăreia dintre fazele ulterioare (a se vedea diagrama de mai jos).
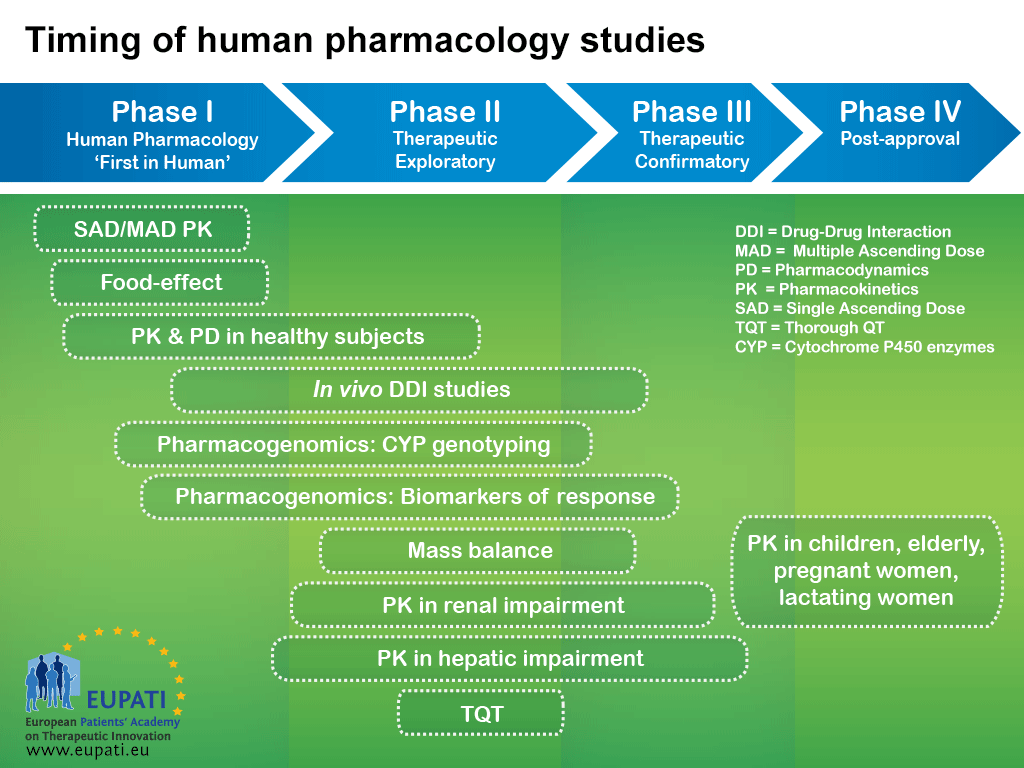
Logica din spatele reprezentării dezvoltării medicamentelor într-o serie de faze consecutive provine din ideea că rezultatele studiilor anterioare ar trebui să influențeze planurile pentru studiile ulterioare: datele care apar vor iniția frecvent modificări ale strategiilor de dezvoltare.
Care sunt obiectivele dezvoltării clinice timpurii?
Studiile din cadrul dezvoltării clinice timpurii se concentrează asupra siguranței și tolerabilității noului medicament. De asemenea, acestea încearcă să demonstreze că medicamentul poate avea efectul scontat.
În timpul dezvoltării clinice timpurii trebuie să se răspundă la următoarele întrebări-cheie:
- Este medicamentul sigur la om? La ce niveluri? (Toleranță)
- Ce face organismul la medicament? (Farmacocinetică (PK))
- Ce efect are medicamentul asupra organismului? (Farmacodinamică (PD))
- Medicamentul este activ?
- Este medicamentul sigur pentru pacienți? (Siguranță)
- Ce efect are medicamentul asupra organismului? (Farmacodinamică (PD))
- Medicamentul pare să funcționeze la pacienți? La ce doză (doze)? (Efect)
- Cum ar trebui concepute studiile de confirmare? (Criterii finale, populația țintă, alte medicamente luate (concomitent) etc.)
- Ce interacțiuni există? (Interacțiuni medicament-medicament, interacțiuni cu alimentele și băuturile etc.)
Care sunt cerințele pentru dezvoltarea clinică timpurie?
Înainte de a putea începe dezvoltarea clinică timpurie a unui medicament, trebuie să existe suficiente date din studiile neclinice care să susțină siguranța medicamentului pentru administrarea la om. Apoi, trebuie să se întocmească un plan de dezvoltare clinică care:
- Stabilește obiectivele programului clinic.
- Stabilește cerințele care trebuie îndeplinite pentru a considera pozitivă o dovadă de concept.
- Descrie proiectarea și desfășurarea studiilor clinice de fază I și de fază II.
Cum se iau deciziile în timpul dezvoltării clinice timpurii?
Deciziile de dezvoltare sunt bazate pe date. Rezultatele studiilor sunt analizate cu atenție înainte de a continua dezvoltarea. Dovada conceptului trebuie să fie realizată și trebuie selectat un program de dozare înainte ca dezvoltarea să poată continua. Dacă dezvoltarea clinică timpurie a unui medicament dă rezultate pozitive, atunci pot continua mai multe teste ale medicamentului. Rezultatele neclare în timpul dezvoltării clinice timpurii necesită teste și evaluări suplimentare înainte de a se putea lua decizii. În cazul în care dezvoltarea clinică timpurie a unui medicament dă rezultate negative – de exemplu, dacă conceptul nu este dovedit în mod adecvat sau dacă apar probleme de siguranță inacceptabile – atunci dezvoltarea medicamentului se oprește. Acesta este punctul în care dezvoltarea unui număr mare de medicamente potențiale trebuie întreruptă.
A2-5.03.1-V1.2
[Disclaimer: Traducerea afișată a fost creată cu ajutorul unui sistem de procesare automată a limbajului].


