Last update: 29 9月 2016
はじめに
早期臨床開発 (第 I 相および第 II 相) の際に一般的に実施される試験には、さまざまな目的があります。こうした早期治験では、何よりもまず治験医薬品がヒトにとって安全であることを確認する必要があります。また、その薬剤が対象となる疾患や症状に対して有効だと示すことも目的とされます。
早期臨床開発においては、次のような重要な質問に対する答えを得る必要があります。
- 第 I 相
- この薬剤はヒトにとって安全か。その場合、どのくらいのレベルが安全か。(忍容性)
- 身体はこの薬剤に対して何をするか。(薬物動態 (PK))
- この薬剤は身体に対して何をするか。(薬力学 (PD))
- どのような相互作用があるか。(薬物間相互作用、飲食物との相互作用など)
- この薬剤には活性があるか。
- 第 II 相
- この薬剤は患者にとって安全か。(安全性)
- この薬剤は身体に対して何をするか。(薬力学 (PD))
- この薬剤は患者に効くように思われるか。その場合、どのくらいの用量か。(効果)
- 検証的試験はどのようにデザインする必要があるか。(エンドポイント、標的集団、投与中のその他の薬剤 (併用薬) など)
医薬品の開発は通常、時系列的な一連の相で表されますが、各相で実施される試験は通常それぞれの目的に基づいて分類されます。下の図に見られるように、一般的に早期の相の一部となっている試験は、医薬品開発プロセスの後期に新しく得られたデータによって追加情報が必要になると実施される場合があります。
単回投与および反復投与漸増試験 (SAD および MAD)
単回投与漸増 (SAD) および反復投与漸増 (MAD) 試験は通常、ファースト イン ヒューマン試験となります。
試験の目的
SAD および MAD 試験:
- 安全性および忍容性を調査
- 最大耐量 (MTD) を特定
- 一般的な薬物動態 (PK) 特性を調査
- 体内において長期的に安定した薬剤レベルを達成する方法を調査 (この条件は定常状態パラメータ (蓄積時間依存性) と呼ばれます)
- 体内からの薬剤排出の予備的な診断検査を実施 (代謝物を特定する)
試験デザイン
SAD および MAD 試験における初回用量は、非臨床毒性試験の結果に基づいて決定されます。その後、規制ガイドライン文書に規定された用量漸増スキームに従って用量を増やしていきます。試験の中止は、毒性および毒性欠如 (最大暴露、最大薬効など) を含む打ち切り規則に従って行われます。
「マス バランス」試験:吸収、分布、代謝、排泄 (ADME)
試験の目的
ADME 試験の目的は、治験医薬品の薬物動態 (PK) プロファイルを理解し特性化することです。これはつまり、身体がその薬剤に対して何をするかということです。この試験では身体が薬剤をどのように吸収し、薬剤がどのように全身に分布し、身体がどのように薬剤を代謝し、そして身体がどのように薬剤を排出するかを調査します(下図参照)。
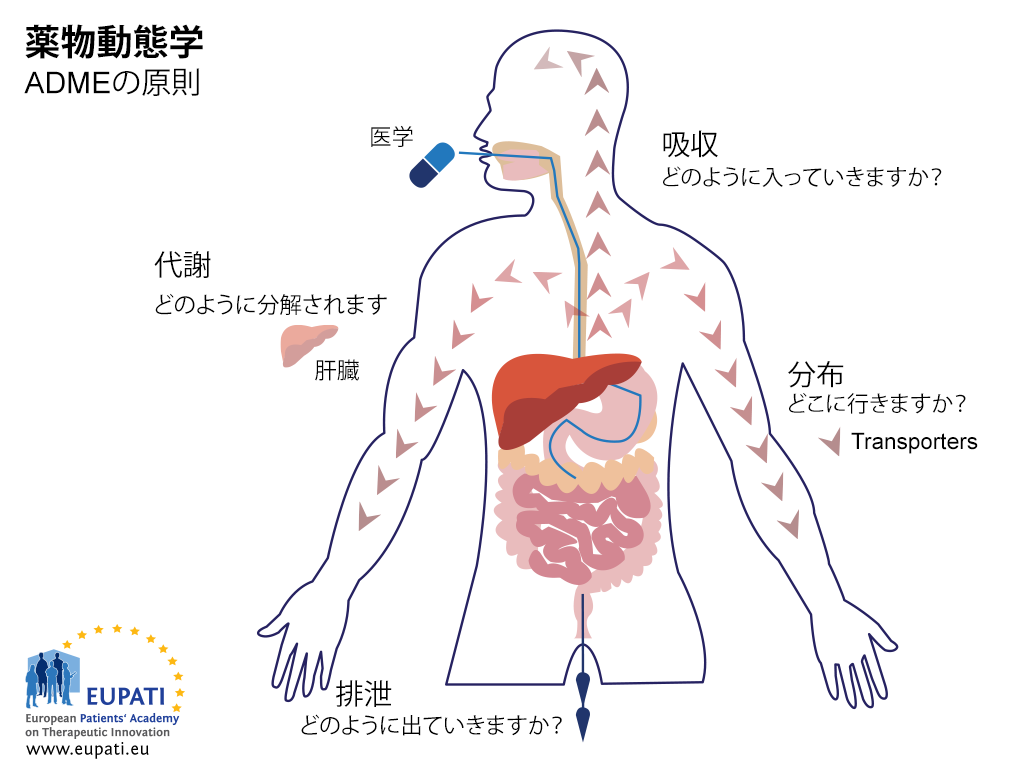
薬物動態学(体が薬に対して持つ影響を研究するもの)の主要な原則は、ADMEという頭字語で表されています。免責事項:この画像は、信頼できるAI支援翻訳ツールを使用して翻訳されました。その精度と多言語の広範な能力が証明されています。
試験デザイン
ADME 試験は通常、少数 (通常 4 ~ 6 名) の健康な男性を対象に (妊娠可能な女性に対する弊害の可能性を除外するため)、目的の投与経路で薬剤を単回投与して実施されます。この試験は一般的に、医薬品開発の第 I 相に関連付けられていますが、開発プロセスのどの段階においても実施される場合があります。
ADME 試験では、バイオアベイラビリティ、すなわち有効医薬成分 (API) の用量のうち血流に到達する割合についての情報も得ることができます。
生物学的利用能 (BA) 試験と生物学的同等性 (BE) 試験
試験の目的
バイオアベイラビリティ試験では、薬剤の吸収率および吸収量を評価します。ここでは経時的な血流中の有効医薬成分 (API) の濃度が調査されます。
異なる経路で投与された薬剤は、異なるバイオアベイラビリティ プロファイルを持ちます。たとえば、静脈内注射 (IV) を通して直接血流中に投与された薬剤は、投与されると同時にバイオアベイラビリティ 100% となりますが、経口投与された薬剤は吸収されて血流に入るまで生物学的に利用可能 (バイオアベイラブル) とはなりません。
バイオアベイラビリティ試験では、血流中の薬剤の最大濃度 (Cmax) およびその最大濃度が発生した時間 (Tmax) を測定することで、薬剤の吸収率を評価します。曲線下面積 (AUC) は身体の薬剤に対する総暴露量を表し、吸収量の調査に利用されます。
試験デザイン
この試験は通常、健康な参加者に対するクロスオーバー無作為化単回投与試験として実施されます。研究者は参加者の血液および血漿中における薬剤の濃度とその主な活性代謝物を測定します。
生物学的同等性試験
生物学的同等性試験では、2 つの異なる製剤の関係を調査します。また薬剤の吸収率および吸収量も調べますが、それは別の薬剤または同じ薬剤の異なる剤形 (参照剤形または参照薬剤) の吸収率および吸収量との比較に利用します。生物学的同等性試験はジェネリック医薬品を先発薬と比較するために使用されます。薬剤が他の薬剤と生物学的に同等であると見なされるには、一連の条件を満たすことが必要になります。
食事の影響試験
試験の目的
食事の影響試験では、特定の剤形による薬剤の吸収率、吸収量、およびバイオアベイラビリティに対する食事の影響が評価されます。食事の影響試験から得られる情報は、添付文書 (PL) に記載される用法 (空腹時と食後のどちらに服用すべきかの指示) を作成するために重要となります。
試験デザイン
この試験は通常、2 つの条件を比較する単回投与クロスオーバー試験になります。つまり参加者は絶食するか、または高脂肪・高カロリー食を提供されます。この試験には通常 2 種類の手順があり、健康な参加者に対して、薬剤の予想される最高強度を用いて実施されます。
腎機能障害試験
試験の目的
腎機能障害試験の目的は、さまざまなレベルの腎機能を持つ人々で薬剤を評価することです。この試験では体内からの薬剤排出に対する腎機能障害の影響と、さまざまなステージの腎機能障害を抱える患者への推奨用量についての情報が収集されます。
試験デザイン
腎機能障害試験は、健康な男女のボランティア (1 群あたり約 6 名) を対象とする単回投与並行群試験として実施されます。各群は腎機能バイオマーカーに基づいて層別化されます。
肝機能障害試験
試験の目的
肝機能障害試験の目的は、さまざまなレベルの肝機能障害を持つ人々で薬剤を評価することです。この試験では、薬剤とその代謝物の薬物動態に対する肝機能障害の影響を検討し、さまざまなステージの肝機能障害に対して有効性や安全性を根拠とする推奨用量を提示します。
試験デザイン
以前の研究の薬物動態結果が直線的かつ時間非依存的である場合、肝機能障害試験は通常、さまざまな程度の肝機能障害を持つ健康な男女のボランティア (約 8 名) を対象とする並行群試験として実施されます。治療群は肝機能障害の標準的分類に基づいて層別化されます。
薬剤が遺伝的変異によってのみ生じる酵素によって代謝される場合は、参加者をその遺伝子型ステータスに基づいて評価する必要があります。
医薬品相互作用 (薬物間相互作用、DDI) 試験
試験の目的
医薬品相互作用試験 (一般に薬物間相互作用 (DDI) 試験と呼ばれる) では、治験医薬品 (IMP) の薬物動態に対する併用薬の影響、および併用薬の薬物動態に対する IMP の影響を評価します。
試験デザイン
この試験は以前の試験管内 (in vitro) 試験の結果をガイドとして行われるもので、クロスオーバー試験デザインを使用することが望まれます。医薬品相互作用試験は健康なボランティアを対象に実施されますが、薬剤の毒性が強すぎるため (抗がん剤の場合など) 薬力学的エンドポイントを評価することが望ましい場合は、患者を対象に実施されます。
この試験では通常、クロスオーバー試験デザインを利用します。容量、投与間隔、投与の回数、経路、および同時投与のタイミングは、相互作用を検出できる可能性を最大化するようにデザインし、臨床環境を模倣する必要があります。相互作用 (抑制または誘導) の量は、いずれかの治験医薬品の吸収の変化によって分類されます。これはその物質の曲線下面積 (AUC) として計算されます。
QT 評価試験 (TQT)
試験の目的
QT 間隔は心リズムの尺度です。QT 間隔は心電図 (ECG) を用いて測定することができ、医薬品が不整脈を引き起こすリスクを評価するためのバイオマーカーとして (不十分であるものの) 使用されます。ECG では心臓の電気的活動が測定され、「P」、「Q」、「R」、「S」、「T」波と分類される波形で表示されます。QT 間隔は、Q 波の開始点から T 波の終了点までを測定したものです。
試験デザイン
TQT 試験はすべての新規化合物 (NME) について生体内 (in vivo) で実施されます。これは試験管内試験や非臨床試験の所見にかかわらず、必ず第 III 相試験の前に行う必要があります。
TQT 試験は通常、健康な参加者を対象とした単回投与クロスオーバー試験として実施されます。研究者は治療域およびそれを超える用量の薬剤を、陽性対照 (モキシフロキサシンのような一般的な抗生物質など) および陰性対照 (プラセボ) と比較して検討します。
A2-5.03.4-V1.1


