Last update: 29 сентября 2016
Введение
Цели исследований, которые обычно проводятся во время ранней клинической разработки (1-й и 2-й фаз), разные. В таких ранних клинических исследованиях прежде всего должна быть установлена безопасность применения исследуемого медицинского препарата для людей. Также они должны показать эффективность лекарственного препарата в лечении целевого заболевания или показания.
Во время ранней клинической разработки должны быть получены ответы на приведенные ниже ключевые вопросы:
- 1 фаза
- Является ли лекарственный препарат безопасным для людей? В каких дозах? (переносимость)
- Какое влияние оказывает организм на медицинский препарат? (фармакокинетика (ФК))
- Какое влияние оказывает медицинский препарат на организм? (фармакодинамика (ФД))
- Какие существуют взаимодействия? (межлекарственные взаимодействия, влияние приема пищи и напитков на ФК лекарственного препарата и т. д.)
- Является ли лекарственный препарат активным?
- Фаза II
- Является ли лекарственный препарат безопасным для пациентов? (безопасность)
- Какое влияние оказывает медицинский препарат на организм? (фармакодинамика (ФД))
- Является ли лекарственный препарат, по всей видимости, действенным у пациентов? В какой/каких дозе/дозах? (действие)
- Как следует планировать проведение подтверждающих исследований? (конечные точки, целевая популяция, другие принимаемые (сопутствующие) лекарственные препараты и т. д.)
Хотя разработка лекарственных препаратов обычно представлена в виде хронологической серии фаз, исследования, проводимые во время каждой фазы, обычно классифицируются по их целям. Как показано на диаграмме ниже, исследования, которые проводятся обычно во время более ранней фазы, могут быть проведены позже в процессе разработки лекарственного препарата, если полученные данные показывают необходимость в сборе дополнительной информации.
Исследования однократных/многократных нарастающих доз (ОНД и МНД)
Исследования однократных нарастающих доз (ОНД) и многократных нарастающих доз (МНД) обычно являются исследованиями впервые с участием людей.
Цели исследования
Исследования ОНД и МНД:
- изучить безопасность и переносимость препарата;
- определить максимальную переносимую дозу (МПД);
- изучить общие фармакокинетические (ФК) характеристики;
- изучить способ достижения стабильного уровня содержания лекарственного препарата в организме в динамике по времени, такие состояния известны как равновесные показатели (зависимость кумуляции препарата от времени);
- предварительно изучить выведение лекарственного препарата из организма (определение метаболита(-ов)).
Дизайн исследования
Начальную дозу для исследований ОНД/МНД определяют по результатам доклинических токсикологических исследований. Затем дозу повышают согласно схемам повышения дозы, предусмотренным регуляторными руководствами. Проведение исследований прекращается согласно соответствующим правилам, которые включают наличие и отсутствие токсичности (максимизированное воздействие, максимизированная фармакодинамика и т. д.).
Исследования баланса масс: абсорбция, распределение, метаболизм, экскреция (ADME)
Цели исследования
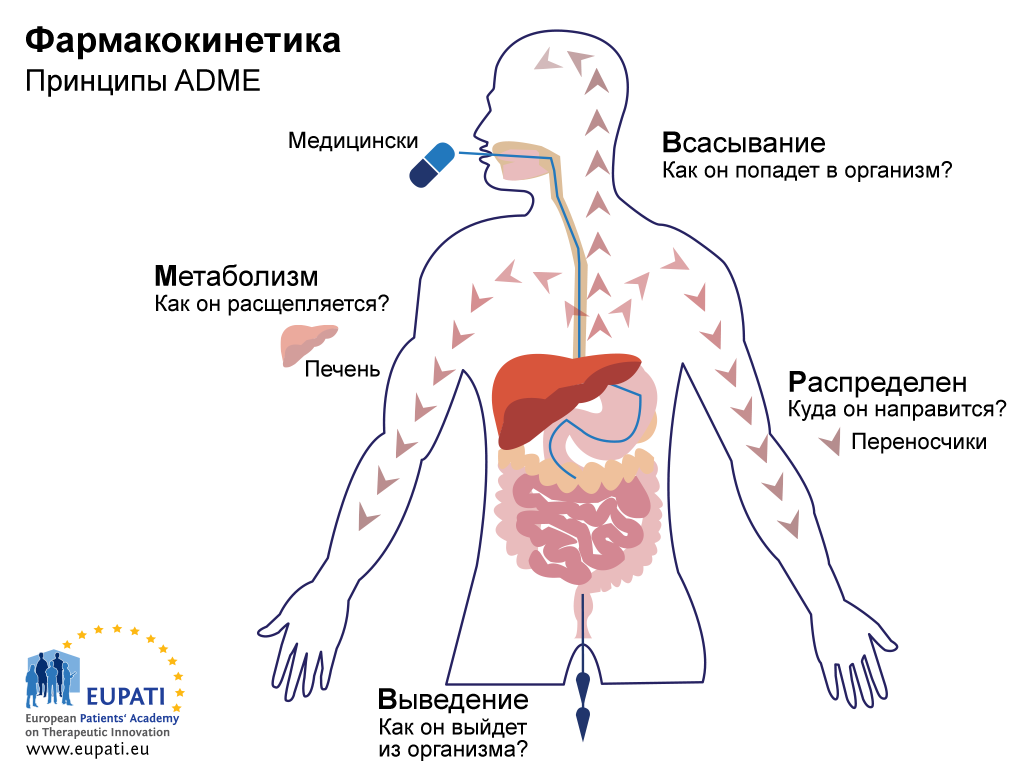
Целью исследований ADME является понять и описать фармакокинетический (ФК) профиль исследуемого медицинского препарата: иными словами, как организм реагирует на препарат. В этих исследованиях изучается то, как лекарственный препарат абсорбируется, распределяется, метаболизируется в организме и выводится из него (см. рисунок ниже).
- Основные принципы фармакокинетики — изучения воздействия организма на медицинский препарат — обозначаются аббревиатурой ADME.
Дизайн исследования
Исследования ADME обычно проводятся с целевым однократным применением лекарственного препарата у небольшого числа (обычно у четырех-шести человек) здоровых мужчин (для исключения возможного вреда для женщин, способных к деторождению). Эти исследования, как правило, связаны с 1-й фазой разработки препарата, но они могут проводиться в процессе разработки медицинского препарата.
В исследованиях ADME также получают информацию по биодоступности препарата, иными словами, о фракции введенной дозы активного фармацевтического ингредиента (АФИ), которая достигает кровотока.
Исследования биодоступности (БД) и биоэквивалентности (БЭ)
Цели исследования
В исследованиях биодоступности оценивается скорость и степень абсорбции лекарственного препарата. В них изучается динамика концентрации активного фармацевтического ингредиента (АФИ) в кровотоке.
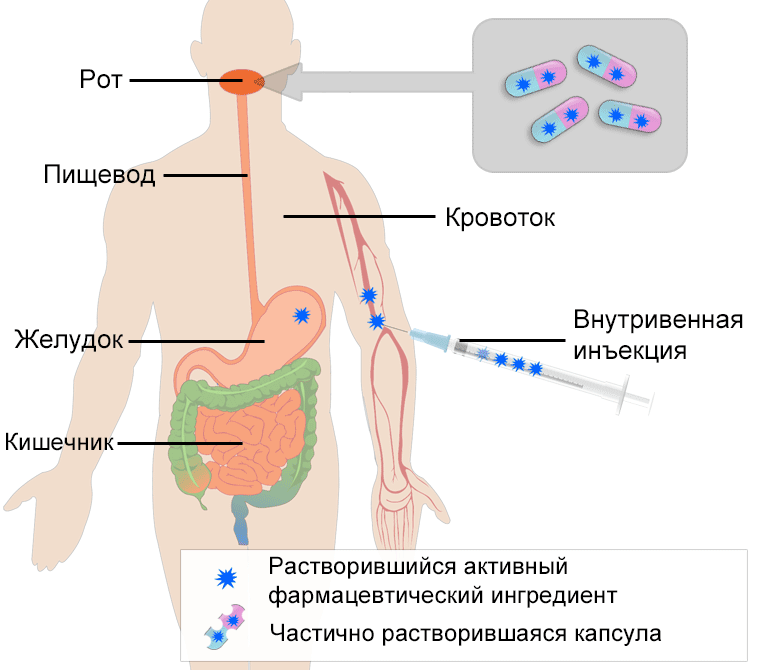
Профили биодоступности лекарственных препаратов отличаются при введении препаратов разными способами. Например, лекарственные средства, которые вводятся непосредственно в кровоток в виде внутривенной инъекции (в. в.), обладают 100 % биодоступностью сразу после их введения, тогда как лекарственные препараты, которые принимаются перорально, становятся биодоступными после попадания лекарственного средства в кровоток после его абсорбции.
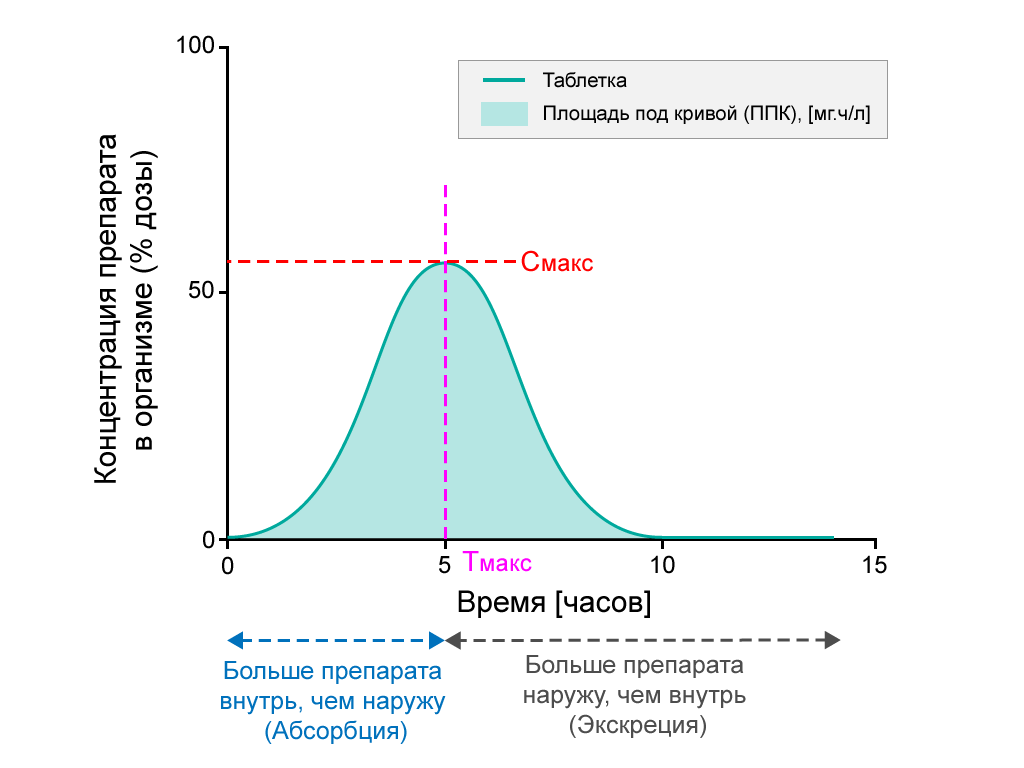
В исследованиях биодоступности оценивается скорость абсорбции лекарственного препарата путем определения его максимальной концентрации (Cmax) в кровотоке и времени ее достижения (Tmax). Площадь под фармакокинетической кривой (AUC) представляет собой общее воздействие лекарственного препарата на организм и используется для изучения степени абсорбции препарата.
- Исследование процентного содержания активного вещества после перорального приема таблетки в течение 15 часов. ППК затемнена. Tмакс — это момент, когда концентрация медицинского препарата в кровотоке является самой высокой, а Cмакс отражает максимальную концентрацию медицинского препарата в крови.
- Схематическое изображение усвоения принятой перорально капсулы и инъекции, введенной непосредственно в кровоток (внутривенной инъекции). После попадания в желудок капсула переносится в тонкий кишечник, где происходит дальнейшее всасывание.
Дизайн исследования
Эти исследования обычно проводятся как перекрестные, рандомизированные исследования с однократным введением препарата здоровым участникам. Исследователи определяют концентрацию лекарственного препарата и его основных активных метаболитов в плазме и крови участников исследования.
Исследования биоэквивалентности
В исследованиях биоэквивалентности изучается взаимосвязь между двумя разными лекарственными формами. В них скорость и степень абсорбции лекарственного препарата не только изучается, но и сравнивается с этими показателями другого лекарственного препарата или другой лекарственной формы этого же лекарственного препарата (лекарственная форма/лекарственный препарат сравнения). Исследования биоэквивалентности используются для сравнения препаратов-дженериков с препаратами сравнения. В них установлены критерии, которым лекарственный препарат должен соответствовать до того, как он может считаться биоэквивалентным другому препарату.
Исследования влияния приема пищи
Цели исследования
В этих исследованиях оценивается влияние приема пищи на скорость, степень и биодоступность лекарственного препарата в данной лекарственной форме. Информация, полученная в этих исследованиях, имеет важное значение для инструкций по применению препарата, которые изложены в листке-вкладыше к препарату, с указанием того, следует ли лекарственный препарата применять на голодный желудок или после приема пищи.
Дизайн исследования
Обычно это перекрестные исследования с однократным применением препарата, в которых сравнивается применение препарата при двух состояниях: участники, которые воздерживались от приема пищи, в сравнении с участниками, которые питались высококалорийной пищей с высоким содержанием жиров. Такое исследование обычно включает две последовательности применения препарата и проводится с участием здоровых лиц с использованием максимальной предполагаемой дозировки лекарственного препарата.
Исследования применения препарата при нарушении функции почек
Цели исследования
Целью таких исследований является оценить применение препарата у людей с разной степенью нарушения функции почек. В этих исследования осуществляется сбор информации о влиянии нарушения функции почек на выведение лекарственного препарата из организма и разработка рекомендаций по дозировкам препарата для пациентов с разной степенью нарушения функции почек.
Дизайн исследования
Исследования применения препарата при нарушении функции почек проводятся с однократным применением препарата в параллельных группах с участием здоровых добровольцев мужского и женского пола (примерно по шесть человек на группу). Группы стратифицируют на основании биомаркеров функции почек.
Исследования применения препарата при нарушении функции печени
Цели исследования
Целью таких исследований является оценить применение препарата у людей с разной степенью нарушения функции печени. В них изучается влияние нарушения функции печени на фармакокинетику лекарственного препарата и его метаболитов, а также определяются рекомендации по дозировке препарата при разной стадии нарушения функции печени по причинам, связанным с эффективностью и/или безопасностью лекарственного препарата.
Дизайн исследования
Если фармакокинетические результаты предыдущих исследований линейные и не зависят от времени, то исследования применения препарата при нарушении функции печени обычно проводятся в параллельных группах с участием здоровых добровольцев мужского и женского пола (примерно восемь человек) с разной степенью нарушения функции печени. Группы лечения стратифицируют в соответствии со стандартными классификациями нарушения функции печени.
Если лекарственный препарат метаболизируется ферментом, которые возникает по причине генетической изменчивости, то участники должны оцениваться по их статусу генотипа.
Исследования лекарственного взаимодействия (межлекарственного взаимодействия, МЛВ)
Цели исследования
В исследованиях лекарственного взаимодействия (более известные как исследования межлекарственного взаимодействия) оценивается влияние сопутствующего применения препарата на фармакокинетику исследуемого лекарственного препарата (ИЛП), а также влияние ИЛП на фармакокинетику препаратов сопутствующей терапии.
Дизайн исследования
Основную роль в этих исследованиях играют полученные раннее результаты in vitro. Эти исследования преимущественно проводятся с использованием перекрестного дизайна исследования. Исследования лекарственного взаимодействия проводятся с участием здоровых добровольцев или пациентов, если их участие желательно для оценки фармакодинамических конечных точек, когда лекарственные препараты являются сильно токсичными (например, противоопухолевый препарат).
Обычно в таких исследованиях используется перекрестный дизайн. Доза, интервалы дозирования, количество доз, способы и время сопутствующего применения препаратов должны быть запланированы таким образом, чтобы свести к максимуму возможность обнаружения взаимодействия между препаратами. Такие исследования должны имитировать клинические условия. Степень взаимодействия (ингибирование/индукция) классифицируется по изменению абсорбции одного из исследуемых лекарственных препаратов и рассчитывается как площадь под фармакокинетической кривой (AUC) вещества.
Тщательное исследование влияния препарата на интервал QT
Цели исследования
Интервал QT является показателем сердечного ритма. Интервал QT можно измерить с помощью электрокардиографии (ЭКГ) и использовать в качестве (неполноценного) биомаркера для оцени риска развития аритмии под действием препарата. С помощью ЭКГ измеряется электрическая активность сердца и изображается в виде зубцов с обозначениями «P», «Q», «R», «S» и «T». Интервал QT измеряют от начала зубца Q до конца зубца Т.
Дизайн исследования
Исследования TQT проводятся в условиях in vivo для всех новых молекулярных соединений (НМС). Они должны проводиться перед исследованиями 3-й фазы независимо от результатов in vitro или доклинических исследований.
Как правило, исследования TQT проводятся как перекрестные исследования с однократным применением препарата у здоровых участников. Исследователи оценивают терапевтические и сверхтерапевтические дозы (превышающие терапевтические дозы) лекарственного препарата в сравнении с положительным контролем (например, с распространенным антибиотиком моксифлоксацин) и отрицательным контролем (плацебо).
A2-5.03.4-V1.1