様々な利害関係者との患者参加に関する既存の実践規範は、研究開発(R&D)の全範囲を包括的にカバーしていない。欧州医薬品庁(EMA)は2006年以来、患者や消費者団体との包括的な交流の枠組みを構築してきた。
欧州患者アカデミー(EUPATI)のガイダンス文書は、規制当局、医療技術評価(HTA)機関、倫理委員会、製薬企業との医薬品研究開発の全過程における患者の関与の統合を支援することを目的としている。
利用者は、特定の状況、国内法、またはそれぞれの相互作用の固有のニーズに応じて、ガイダンスから逸脱することができる。ガイダンス文書は、専門家としての最善の判断に基づき、個々の要件に適合させる必要がある。ガイダンスの編集はこちらで読むことができる。
EUPATIは、研究開発(R&D)の領域における患者参加について、4つの包括的なガイダンス文書を発表した。これらのガイダンス文書は、倫理委員会、医療技術評価機関、規制プロセス、製薬企業主導の医薬品研究開発など、重要な側面をカバーしています。
各ガイダンス文書は、作業方法やプロセスを推奨し、患者参加のための具体的な活動や分野を提案している。各ガイダンスは、患者参画の機会がある重要な分野を示唆している。効果的で透明性の高い相互作用を促進する方法に関する実践的な推奨を提供するだけでなく、必要とされる患者からのインプットのタイプに関する貴重な洞察も提供しています。これには、患者の逸話的な経験から引き出される個人的なインプット、より広範な患者のニーズを代表する患者アドボケイトからの貢献、患者団体によって提唱される正式な立場、経験的な知識に加え、技術的なスキルやトレーニングを有する患者専門家からのインプットなどが含まれる。
進化する基準や法律との整合性を確保するため、すべてのガイダンス文書は、この分野のダイナミックな性質を反映して、定期的な見直しと改訂が行われています。
1. 製薬企業主導の医薬品研究開発における患者参加のためのガイダンス
本稿のEUPATIガイダンス文書は、製薬企業における医薬品研究開発の全プロセスに患者参加を統合するための基本的なルールと提案の提言を提供することを目的とし、患者が参加し、将来の医薬品研究開発に影響を与えることができる具体的な活動の概要を示している。
2. HTAにおける患者参加のためのガイダンス
本ガイダンスには、医薬品の研究開発プロセス全体に適用される「包括的原則」、ガイダ ンスの免責事項、ガイダンスの範囲、EUPATIが採用した「患者」の定義の説明、ガイダンスを作成した理 由、欧州におけるHTAへの患者参加に関する背景情報、ガイダンスの最終目的が含まれてい る。これらのセクションに続いて、推奨事項(推奨される作業方法と患者参加活動)が記載されている。
3. 規制プロセスにおける患者参加のためのガイダンス
本稿のEUPATIガイダンスは、規制分野における患者参加を対象としている。このガイダンスは、主に規制当局がその活動において患者またはその団体と対話することを希望していることを対象としているが、規制当局との協力を計画している患者/患者団体も考慮すべきである。
4. 臨床試験の倫理審査における患者参加のためのガイダンス
本ガイダンスは、EUPATI(European Patient Academy on Therapeutic Innovation)が、臨床研究プロ ジェクトの倫理審査に携わる医薬品開発関係者全員を対象として作成したものであり、特に研究倫理 委員会の委員、患者・介護者または患者代表が患者からの意見を提供することに重点を置いている。
これらのガイダンス文書は、医薬品の研究開発の複雑なプロセスにおける患者参加のための強固な基盤を築き、実践的な推奨と洞察を保証するものです。また、以下の患者参加ロードマップは、研究開発のライフサイクル全体を通じて患者参加のための体系的な枠組みを提供し、関係者がこれらのプロセスを効率的に進めるためのさらなる支援を目的としています。
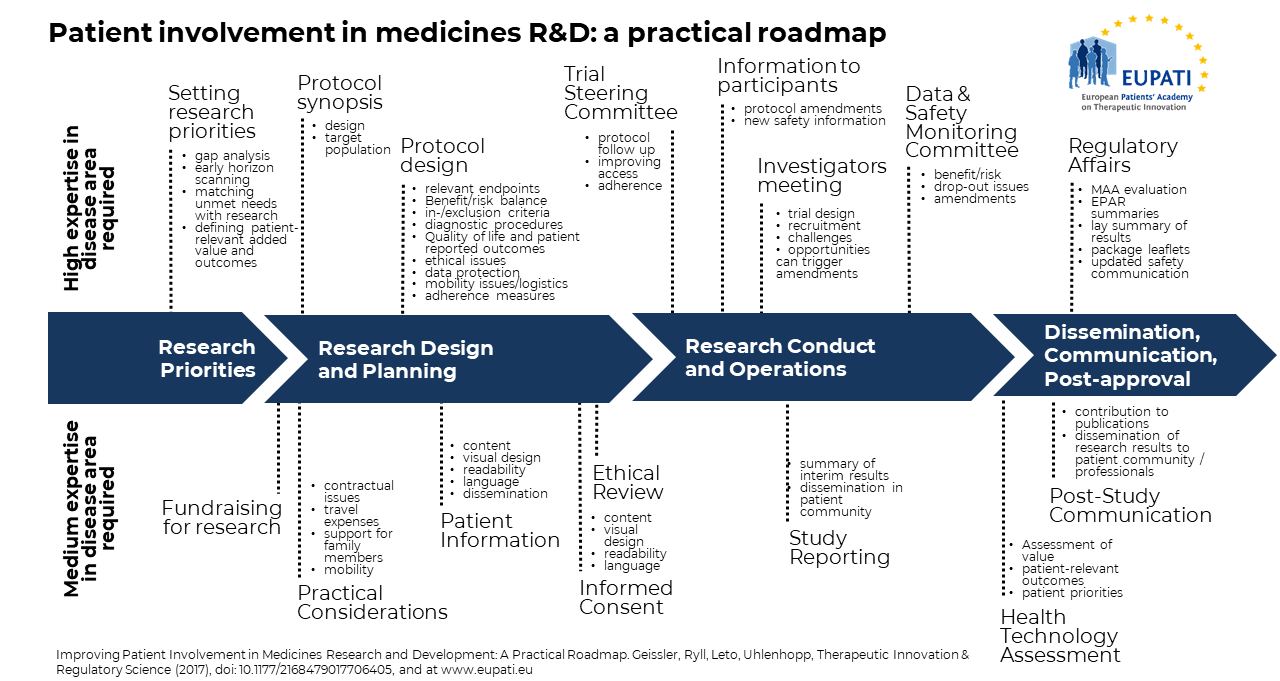
患者参加ロードマップ
EUPATI医薬品研究開発における患者参加ロードマップ ビデオ
EUPATI患者参画ロードマップとは?
医薬品の研究開発における患者参画の価値は、すべてのステークホルダーによってますます認識されるようになっています。しかし残念なことに、患者参加活動の正式な文書化が限られているため、経験と学習の共有が妨げられ、タイムリーで体系的な実施が妨げられています。患者参加は、アプローチの構造や一貫性に欠け、遅すぎることが多い。エンド・ツー・エンドで実践的なガイドラインが必要であり、EUPATI患者参画ロードマップは、医薬品研究開発における患者参画のプロセスモデルであり、これを提供するものである。上の画像をご覧ください: Geissler, J., Ryll, B., Leto di Priolo, S., Uhlenhopp, M.: Improving Patient Involvement in Medicines Research and Development: A Practical Roadmap. Therapeutic Innovation & Regulatory Science 2017).
EUPATI患者参画ロードマップの活用
このロードマップは、医薬品の研究開発ライフサイクルの4つの主要な段階に沿って、患者参画の具体的な機会を強調し、具体的な例を示しています。このロードマップの目的は、このライフサイクルにおける患者参加を促進するツールを提供することであり、実施とさらなる改良を促すために共有される。このロードマップは、さらなる議論の活性化を意図している。すべての利害関係者の利益を最大化するために、学術界と製薬企業、患者団体と患者、臨床医と研究者など、すべての関係者が戦略的な患者参加ポイントの特定とその実施に関与する必要がある。
ロードマップ実施へのEUPATIのコミットメント
ロードマップとガイダンス文書は、様々な利害関係者によって実践される必要があるため、実施を成功させることが重要な課題である。患者を研究に参加させることは、医薬品開発プロセスに大きな利益をもたらします。患者の優先事項や視点を取り入れることで、患者は自分自身や他の人々にとってより良い治療法の開発に貢献することができます。研究開発への患者の参加が増えれば、新しい治療法の有効性と安全性が向上し、医学研究に対する国民の支持も高まります。これを可能にするためには、医薬品が開発され上市されるまでのプロセスや方法について患者が十分な知識を持ち、どこでどのように重要な影響を与えることができるかを理解することが不可欠である。EUPATIの長期的な目標は、患者教育のための厳格なコンテンツ開発、患者専門家のアドボカシー能力の向上、欧州の患者運動の強化に引き続き焦点を当てている。EUPATIはまた、他のステークホルダーを対象とした研修、例えば産業界や学術界で働く専門家を対象とした患者参加研修など、その活動範囲を広げている。
[免責事項:表示された翻訳は、自動言語処理システムの助けを借りて作成されました]。