Last update: 13 stycznia 2016
Wprowadzenie
Zwykły proces rozwoju leku wymaga przeprowadzenia różnych badań w celu zapewnienia jego jakości, bezpieczeństwa i skuteczności. Badania te z kolei wymagają starannych procedur planowania, aby zapewnić, że są etycznie i naukowo uzasadnione. W trakcie procesu opracowywania leku przygotowuje się plan badań pediatrycznych, aby zapewnić, że uzyskano niezbędne dane dotyczące stosowania leku u dzieci w czasie, gdy można to było wykonać w bezpieczny sposób.
Plan badań pediatrycznych (ang. Paediatric Investigation Plan, PIP)
Celem planu badań pediatrycznych jest wsparcie procesu zarejestrowania leku do stosowania u dzieci. Po zatwierdzeniu planu jest on aktualizowany na bieżąco przy pomocy procedur modyfikacji.
Plan badań pediatrycznych zawiera następujące informacje:
- Potrzeby wszystkich grup wiekowych dzieci, od narodzin do okresu dojrzewania, a czas badań u dzieci jest porównywalny z czasem badań przeprowadzanych u dorosłych pacjentów. O ile ma to uzasadnienie, należy wziąć pod uwagę wszystkie grupy wiekowe.
- Przegląd choroby, diagnozę i leczenie. Powinno podkreślać wszystkie różnice między dziećmi i dorosłymi.
- Przegląd dostępnych danych na temat leku, w tym:
- Informacje na temat składu chemicznego bieżącej postaci leku
- Dane pochodzące z badań klinicznych i nieklinicznych
- Proponowaną strategię zawierającą niektóre lub wszystkie z poniższych informacji:
- Opis wszelkich dodatkowych badań nieklinicznych
- Plany dotyczące preparatu dla dzieci (jeżeli jest to wymagane), w tym metody dostosowania postaci leku tak, aby mógł on być łatwiej przyjmowany przez dzieci, na przykład w postaci płynnej, a nie jako duże tabletki
- Opis planowanych badań klinicznych lub modelowania/symulacji (za pomocą komputerów, aby przewidzieć, w jaki sposób lek może działać u dzieci), w tym:
- Informacje szczegółowe na temat czasu badań z udziałem dzieci w porównaniu z planem opracowania leku dla dorosłych
- Jeżeli badania u dzieci nie zostaną zakończone w tym samym czasie, wówczas konieczne może być ich odroczenie w celu ukończenia planu badań pediatrycznych.
Plan badań pediatrycznych jest składany przez wnioskodawcę do Komitetu Pediatrycznego (ang. Paediatric Committee, PDCO). Przepisy wymagają złożenia planu badań pediatrycznych „nie później niż w dniu zakończenia badań farmakokinetycznych prowadzonych z udziałem dorosłych pacjentów”. Zazwyczaj plan badań pediatrycznych jest składany, gdy istnieją dane kliniczne pochodzące z badań przeprowadzanych u dorosłych pacjentów. Jeżeli przygotowano plan badań pediatrycznych i uwzględniono dane pediatryczne w europejskim dossier tego produktu, wówczas jako nagrodę uzyskuje się przedłużenie o 6 miesięcy dodatkowego świadectwa ochronnego (ang. Supplementary Protection Certificate, SPC).
Komitet Pediatryczny (ang. Paediatric Committee, PDCO) działający w ramach EMA
Komitet Pediatryczny ocenia informacje zawarte w planie badań pediatrycznych, wszelkie wnioski o zwolnienia i odroczenia, umożliwia analizę ekspertów i dostarcza krytycznego spojrzenia w celu przyjęcia „opinii” na temat ewentualnego przyjęcia lub odrzucenia planu. W skład Komitetu Pediatrycznego wchodzą przedstawiciele pacjentów.
W razie takiej potrzeby, Komitet oceni dane wygenerowane po zatwierdzeniu planu badań pediatrycznych. Komitet przechowuje także:
- Listę zwolnień dla klas leków lub produktów
- Aktualny wykaz ustalonych potrzeb pediatrycznych będący wynikiem zebranych danych.
Komitet korzysta z tych informacji, aby doradzać europejskim sieciom działającym na rzecz badań pediatrycznych co do chorób, które należy badać i obszarów, w których preparaty pediatryczne istniejących leków są potrzebne.
Prawodawstwo UE podlega ciągłemu przeglądowi i korekcie, co umożliwia optymalizację procesu dostarczania leków pacjentom. Wymagana jest opinia wszystkich zainteresowanych stron, w tym lekarzy, pracowników służby zdrowia, firm farmaceutycznych, pacjentów i organizacji pacjenckich.
Przegląd procedury dotyczącej planu badań pediatrycznych
- Plan badań pediatrycznych jest oceniany przez Komitet Pediatryczny działający w ramach Europejskiej Agencji Leków i podlega ustalonej procedurze z określonymi terminami.
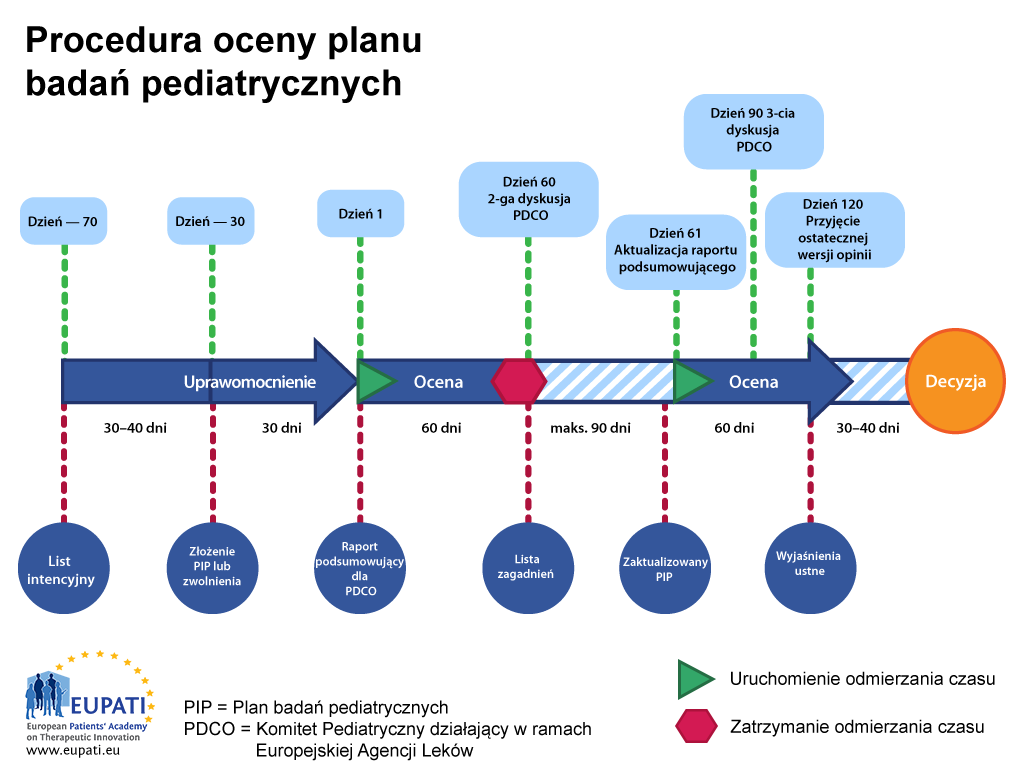
Procedura dotycząca planu badań pediatrycznych trwa od 9 do 10 miesięcy, począwszy od momentu złożenia planu do wydania decyzji. Po złożeniu przez wnioskodawcę „listu intencyjnego”, Komitet Pediatryczny wyznacza ze swego grona „sprawozdawcę”, który będzie kierował oceną oraz „recenzenta”, który sprawdzi jakość oceny. Sprawozdawca i recenzent sprawdzą wstępny plan badań pediatrycznych i przedstawią swoje wnioski Komitetowi Pediatrycznemu.
Przegląd przybiera postać 120-dniowej procedury; w dniu 60-tym zostaje zawieszony (wstrzymanie odmierzania czasu), co umożliwia Komitetowi Pediatrycznemu zadawanie pytań wnioskodawcy. Procedurę wstrzymuje się zazwyczaj na maksymalnie trzy miesiące, choć czas ten uzgadnia się z Komitetem Pediatrycznym na podstawie indywidualnego przypadku.
Po wpłynięciu odpowiedzi wnioskodawcy, zegar ponownie zaczyna „tykać” w dniu 61., a procedura biegnie bez przerwy do momentu zakończenia w dniu 120. Oznacza to, że wszelkie nierozstrzygnięte kwestie muszą być uwzględnione w trakcie procedury. Jeśli jakieś kwestie pozostają nierozstrzygnięte w trakcie trzeciej dyskusji z Komitetem Pediatrycznym, wówczas Komitet lub wnioskodawca mogą poprosić o wyjaśnienie ustne. Umożliwia to wnioskodawcy dyskusję z całym Komitetem.
Zwolnienia dotyczące planu badań pediatrycznych
Zwolnienie uwalniające sponsora z konieczności składania planu badań pediatrycznych może zostać przyznane, jeśli:
- Lek może być nieskuteczny lub niebezpieczny w przypadku stosowania u dzieci;
- Choroba lub schorzenie występuje tylko u dorosłych; lub
- Nie zaobserwowano „znaczących korzyści terapeutycznych” lub istnieją uzasadnione wątpliwości co do możliwości wykonania, co oznacza, że nie można zademonstrować znaczących korzyści terapeutycznych.
Istnieją trzy rodzaje zwolnień:
- Zwolnienie dla klasy produktów — zgodnie z listą wydaną przez Komitet Pediatryczny na temat schorzeń występujących tylko u dorosłych. Komitet Pediatryczny obecnie rozważa wyeliminowanie wszystkich zwolnień dla klasy produktów (głównie związanych z nowotworami).
- Zwolnienie całkowite — dla wszystkich podgrup pediatrycznych i wskazania(ń).
- Zwolnienie częściowe — dla jednej lub większej liczby podgrup pediatrycznych i wskazania(ń).
Zwolnienia podlegają przeglądowi i mogą zostać zmienione. Jeżeli zwolnienie zostanie uchylone, wówczas wymóg przedkładania danych zgodnie z ustalonym planem badań pediatrycznych nie będzie obowiązywać przez okres 36 miesięcy.
Inne materiały i zasoby
- Aby uzyskać dodatkowe informacje na temat ról komitetu pediatrycznego, patrz: European Medicines Agency (2010). Roles and responsibilities of members and alternates, rapporteur and peer reviewers, experts and observers of the Paediatric Committee (PDCO). Pobrano 25 sierpnia 2015 r. ze strony http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/10/WC500004754.pdf
- Aby uzyskać dodatkowe informacje na temat komitetu pediatrycznego, patrz: European Medicines Agency (2015). PDCO: Overview. Pobrano 25 sierpnia 2015 r. ze strony http://www.ema.europa.eu/ema/index.jsp?curl=pages/about_us/general/general_content_000124.jsp&mid=WC0b01ac0580028e9e
- Najczęściej zadawane pytania na temat procedury dotyczącej planu badań pediatrycznych znajdują się w: European Medicines Agency (2014). Questions and answers on the procedure of PIP compliance verification at EMA, and on paediatric rewards. Pobrano 25 sierpnia 2015 r. ze strony http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/09/WC500003916.pdf
A2-1.18.4-v1.1