Last update: 13 Gennaio 2016
Introduzione
Il normale sviluppo di un medicinale richiede l’esecuzione di vari studi al fine di assicurarne la qualità, la sicurezza e l’efficacia. Questi studi, a loro volta, richiedono attente procedure di pianificazione al fine di accertarne la validità sia sul piano etico, sia su quello scientifico. Durante il processo di sviluppo, viene redatto un piano di indagine pediatrica allo scopo di assicurare che tutti i dati necessari riguardanti l’uso del farmaco nei bambini siano ottenuti quando ciò è possibile in condizioni di sicurezza.
Piano di Indagine Pediatrica (PIP)
Lo scopo di un PIP è quello di supportare l’autorizzazione di un medicinale per l’uso nei bambini. Una volta accettato, il PIP viene costantemente aggiornato per mezzo di una procedura di modifica.
Un PIP conterrà quanto segue:
- Le necessità di tutte le fasce di età dei bambini, dalla nascita all’adolescenza, nonché la tempistica degli studi nei bambini rispetto agli adulti. Deve essere coperta l’intera gamma delle fasce di età pediatriche, salvo giustificazione in senso contrario.
- Una panoramica della malattia, come pure della rispettiva diagnosi e del trattamento. Occorre evidenziare eventuali differenze tra bambini e adulti.
- Una panoramica dei dati disponibili, tra cui:
- Le informazioni chimiche sull’attuale formulazione
- I dati degli studi non clinici e clinici
- La strategia proposta tra cui alcuni o tutti gli elementi riportati di seguito:
- Una descrizione di eventuali ulteriori studi non clinici
- I piani per una formulazione pediatrica (se necessaria), tra cui le misure per adeguare la formulazione del medicinale al fine di renderne l’uso più adeguato ai bambini, ad esempio, l’utilizzo di una formulazione liquida invece di compresse di grandi dimensioni
- Una descrizione degli studi clinici pianificati o delle modellizzazioni/simulazioni previste (con l’utilizzo del computer per prevedere in che modo può agire il farmaco nei bambini), tra cui:
- I dati della tempistica degli studi nei bambini rispetto al piano di sviluppo per gli adulti
- Se gli studi sui bambini non vengono ultimati in parallelo, può essere richiesta una proroga per il completamento del PIP.
Il PIP viene presentato dal richiedente al Comitato pediatrico (PDCO). La legislazione richiede la presentazione di un PIP “non oltre la conclusione degli studi farmacocinetici su adulti”. Di solito, il PIP viene presentato una volta determinata l’esperienza clinica sugli adulti. Se un PIP viene completato includendo anche i dati pediatrici nelle informazioni sul prodotto per l’UE, viene concessa una proroga di sei mesi del certificato protettivo complementare (Supplementary Protection Certificate, SPC) come premio.
Il Comitato Pediatrico (PDCO) dell’EMA
Il Comitato Pediatrico (PDCO) valuta il contenuto di un PIP, nonché eventuali richieste di deroghe e differimenti, quindi fornisce l’analisi degli esperti e una visione critica al fine di adottare “un’opinione” intesa a determinare l’accettabilità del PIP. Nel PDCO vi sono anche i rappresentanti dei pazienti.
Su richiesta, il Comitato valuterà i dati generati una volta accettato il PIP. Inoltre, si occupa di mantenere:
- Un elenco delle classi di farmaci o prodotti per le deroghe
- Un inventario aggiornato di esigenze pediatriche determinate attraverso i dati raccolti.
Il Comitato utilizza queste informazioni per consigliare le reti di ricerca pediatrica europee sulle malattie da studiare, come pure per segnalare la necessità di formulazioni pediatriche dei farmaci esistenti.
La legislazione dell’UE è sottoposta continuativamente a esame e revisione, il che consente di ottimizzare il processo di offerta dei farmaci al paziente. Viene richiesto il contributo di tutti gli stakeholder, tra cui i medici, i professionisti sanitari, le aziende farmaceutiche, i pazienti e le organizzazioni dei pazienti.
Presentazione della procedura del PIP
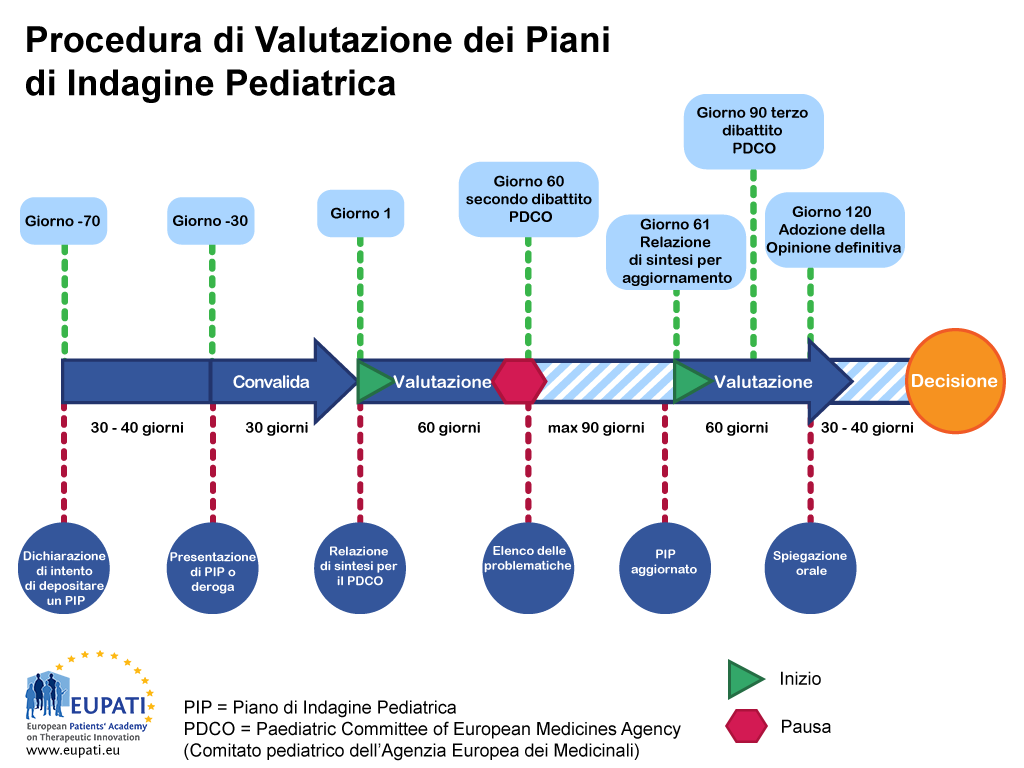
- Un Piano di indagine pediatrica viene valutato dal Comitato pediatrico dell’Agenzia Europea dei Medicinali e segue una procedura ben determinata con una tempistica predefinita.
La procedura del PIP richiede dai 9 ai 10 mesi, dalla presentazione alla decisione. Una volta che un richiedente presenta una dichiarazione di intento di depositare un PIP, il PDCO nomina un relatore per condurre la valutazione e un revisore inter pares per controllare la qualità della valutazione all'interno del Comitato stesso. Il relatore e il revisore inter pares controllano il PIP iniziale e presentano i loro risultati al PDCO.
Il processo di revisione consiste in una procedura della durata di 120 giorni; tuttavia, è prevista una pausa (sospensione) in corrispondenza del Giorno 60 per consentire al PDCO di porre le domande al richiedente. Queste sospensioni di solito non superano i tre mesi, anche se la durata effettiva viene concordata caso per caso con il PDCO.
Una volta presentate le risposte del richiedente, l'orologio riparte il Giorno 61 e la procedura riprende il suo corso senza pause fino al completamento, il Giorno 120. Se resta in sospeso qualche domanda dopo il terzo dibattito con il PDCO, quest'ultimo o il richiedente possono sollecitare una spiegazione orale. Questo consente al richiedente di parlare direttamente con tutto il Comitato.
Deroghe al PIP
Una deroga che esoneri lo sponsor dalla presentazione del PIP può essere concessa quando:
- Il farmaco probabilmente è inefficace o rischioso per i bambini;
- La malattia o il disturbo si riscontrano unicamente negli adulti; oppure
- Non è stato osservato alcun "beneficio terapeutico significativo" o esiste una giustificazione secondo la quale vi sono problemi di fattibilità che non consentono di dimostrare il beneficio terapeutico.
Esistono tre tipi di deroga:
- Deroga di classe - in base a un elenco dei disturbi che riguardano unicamente gli adulti, diffuso dal PDCO. Attualmente il PDCO sta considerando l'eliminazione della deroga di classe (soprattutto il relazione ai tumori)
- Deroga integrale - per tutti i sottoinsiemi pediatrici e tutte le indicazioni
- Deroga parziale - per uno o più sottoinsiemi pediatrici e una o più indicazioni
Le deroghe possono essere riesaminate e modificate. Se una deroga viene revocata, il requisito di presentazione dei dati in base a un PIP accettato non si applicherà per 36 mesi.
Ulteriori risorse
- Per ulteriori informazioni suoi ruoli del PDCO, consultare: Agenzia europea per i medicinali (2010). Roles and responsibilities of members and alternates, rapporteur and peer reviewers, experts and observers of the Paediatric Committee (PDCO). Estratto in data 25 agosto 2015 da http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/10/WC500004754.pdf
- Per ulteriori informazioni sul PDCO, consultare: Agenzia europea per i medicinali (2015). PDCO: Panoramica. Estratto il 25 agosto 2015 da http://www.ema.europa.eu/ema/index.jsp?curl=pages/about_us/general/general_content_000124.jsp&mid=WC0b01ac0580028e9e
- Per le domande frequenti sulla procedura del PIP, consultare: Agenzia europea per i medicinali (2014). Questions and answers on the procedure of PIP compliance verification at EMA, and on paediatric rewards. Estratto in data 25 agosto 2015 da http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/09/WC500003916.pdf
A2-1.18.4-v1.1