Last update: 13 januar 2016
Introduktion
Den almindelige udvikling af et lægemiddel kræver, at der foretages forskellige undersøgelser for at sikre dets kvalitet, sikkerhed og virkning. Disse undersøgelser kræver for deres eget vedkommende omhyggelige planlægningsprocedurer, så man er sikker på, at de er etisk og videnskabeligt korrekte. Under udviklingsprocessen udarbejdes der en pædiatrisk undersøgelsesplan for at sikre, at man indsamler de nødvendige data om brugen af lægemidlet til børn, når denne brug er sikker.
Pædiatrisk undersøgelsesplan (PIP)
Formålet med en PIP er at understøtte godkendelsen til at anvende lægemidlet til børn. Når først PIP’en er vedtaget, ajourføres den ved hjælp af en ændringsprocedure.
En PIP indeholder følgende:
- Behovene hos alle børnealdersgrupper, lige fra nyfødte til unge, og tidsplanen for undersøgelser hos børn sammenlignet med voksne. Hele den pædiatriske aldersskala skal være omfattet, medmindre andet er retfærdiggjort.
- En oversigt over sygdommen, diagnosen og behandlingen. I denne oversigt skal enhver forskel mellem børn og voksne fremhæves.
- En oversigt over de data, der er tilgængelige om lægemidlet, herunder:
- Kemiske oplysninger om den anvendte formulering
- Non-kliniske og kliniske undersøgelsesdata
- Den foreslåede strategi, som omfatter alt eller noget af det følgende:
- En beskrivelse af eventuelle yderligere non-kliniske undersøgelser
- Planerne for en pædiatrisk formulering (hvis en sådan er nødvendig), herunder foranstaltningerne for at tilpasse lægemidlets formulering, så brugen bliver mere acceptabel for børn, f.eks. anvendelse af en flydende formulering i stedet for store tabletter.
- En beskrivelse af de planlagte kliniske forsøg eller modellering/simulation (brug af computere til at forudsige, hvordan lægemidlet vil virke hos børn), herunder:
- Detaljerede oplysninger om tidsplanen for undersøgelser hos børn sammenlignet med udviklingsplanen for voksne
- Hvis undersøgelserne hos børn ikke gennemføres sideløbende, kan der anmodes om udsættelse af PIP’ens afslutning.
Ansøgeren indsender PIP’en til Det Pædiatriske Udvalg (PDCO). I henhold til lovgivningen skal en PIP indsendes senest ved afslutningen af farmakokinetiske undersøgelser hos voksne. Som regel indsendes PIP’en, lige så snart der foreligger kliniske erfaringer hos voksne. Hvis en PIP er afsluttet, og der medtages pædiatriske data i produktinformationen for EU, gives der en belønning i form af seks måneders forlængelse af det supplerende beskyttelsescertifikat (SPC).
EMA’s Pædiatriske Udvalg (PDCO)
Det Pædiatriske Udvalg (PDCO) vurderer indholdet i en PIP og eventuelle anmodninger om dispensation eller udsættelse, og det foretager en ekspertanalyse og en kritisk gennemgang med henblik på vedtagelsen af en “udtalelse” om, hvorvidt PIP’en kan godkendes. I PDCO deltager der patientrepræsentanter.
Efter anmodning vil udvalget vurdere data, der er tilvejebragt, efter at PIP’en er godkendt. Udvalget fører også:
- En liste over lægemiddelklasser eller lægemidler, som har fået dispensation
- En ajourført fortegnelse over fastlagte pædiatriske behov ved hjælp af indsamlede data.
Udvalget anvender disse oplysninger til at rådgive de europæiske pædiatriske forskningsnetværk om, hvilke sygdomme der skal undersøges, og hvor det er nødvendigt med pædiatriske formuleringer af eksisterende lægemidler.
EU-lovgivningen bliver hele tiden gennemgået og revideret, hvilket giver mulighed for at optimere processen med at gøre lægemidlerne tilgængelige for patienterne. Alle interessenter anmodes om input, herunder læger, sundhedspersonale, medicinalvirksomheder, patienter og patientforeninger.
Oversigt over PIP-proceduren
- En pædiatrisk undersøgelsesplan vurderes af Det Europæiske Lægemiddelagenturs Pædiatriske Udvalg og følger en række procedurer med faste tidsfrister.
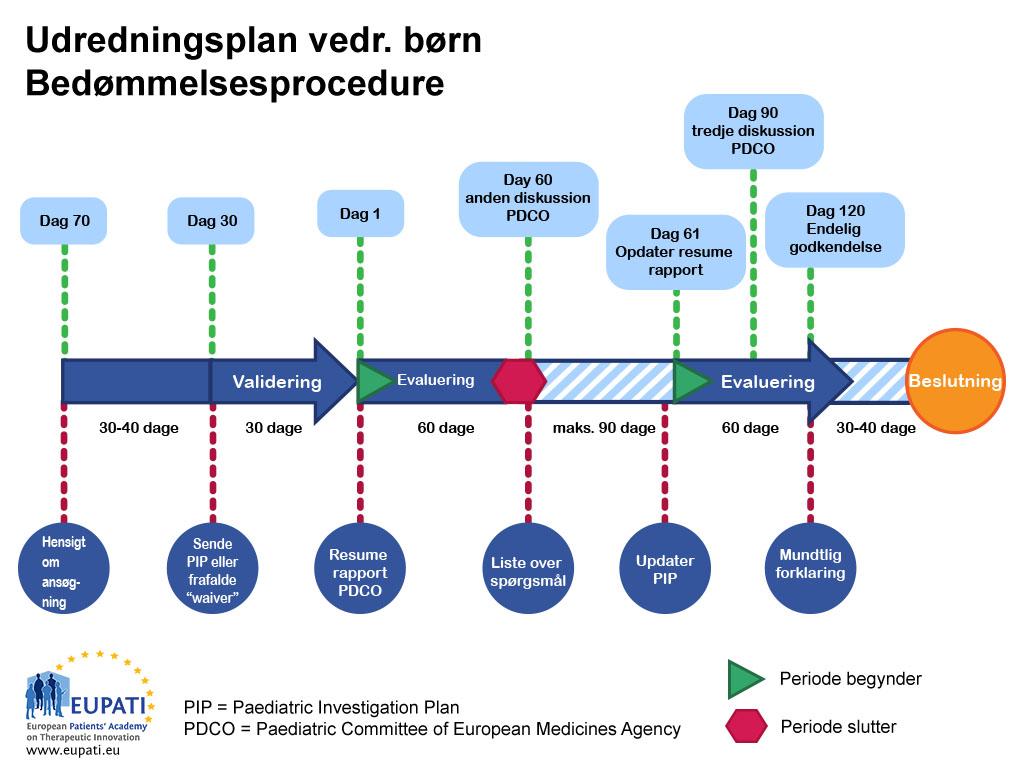
PIP-proceduren tager 9-10 måneder fra indsendelsen til afgørelsen. Når ansøgeren indsender en "hensigt om at ansøge", udpeger PDCO en "ordfører", som står i spidsen for vurderingen, og en "fagfællebedømmer", som skal kontrollere kvaliteten af udvalgets vurdering. Ordføreren og fagfællebedømmeren kontrollerer den oprindelige PIP og forelægger deres resultater for PDCO.
Gennemgangen er udformet som en 120-dages procedure. Der er dog en pause (standsning af proceduren) ved dag 60, som giver PDCO mulighed for at stille spørgsmål til ansøgeren. Disse standsninger af proceduren varer normalt højst tre måneder. Varigheden aftales dog med PDCO fra sag til sag.
Når ansøgerens svar er indsendt, starter proceduren igen ved dag 61, og den fortsætter uden pause, indtil den stopper på dag 120. Det betyder, at alle udestående spørgsmål skal behandles under proceduren. Hvis der stadig er udestående spørgsmål efter den tredje forhandling med PDCO, kan PDCO eller ansøgeren anmode om en mundtlig redegørelse. Dette giver ansøgeren mulighed for at tale direkte med hele udvalget.
PIP-dispensationer
Sponsor kan få dispensation fra at indsende en PIP, når:
- det må antages, at lægemidlet ikke har den tilsigtede virkning eller frembyder den fornødne sikkerhed hos børn
- sygdommen eller tilstanden forekommer kun hos voksne eller
- lægemidlet medfører ikke "betydelige terapeutiske fordele", eller der er begrundede gennemførlighedsproblemer, som betyder, at betydelige terapeutiske fordele ikke kan påvises.
Der er tre slags dispensationer:
- Gruppedispensation – i henhold til en liste, som PDCO har udarbejdet over tilstande, der kun forekommer hos voksne. PDCO overvejer i øjeblikket at fjerne alle gruppedispensationer (som for størstedelens vedkommende vedrører kræft)
- Fuld dispensation – for alle pædiatriske undergrupper og indikationer
- Delvis dispensation – for en eller flere pædiatriske undergrupper og indikationer
En dispensation kan tages op til fornyet overvejelse og ændres. Hvis en dispensation tilbagekaldes, gælder kravet om at indsende data i henhold til en godkendt PIP ikke i 36 måneder.
Flere ressourcer
- For further information on PDCO roles, see: European Medicines Agency (2010). Roles and responsibilities of members and alternates, rapporteur and peer reviewers, experts and observers of the Paediatric Committee (PDCO). Retrieved 25 August, 2015 from http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/10/WC500004754.pdf
- For further information on the PDCO, see: European Medicines Agency (2015). PDCO: Overview. Retrieved 25 August, 2015 from http://www.ema.europa.eu/ema/index.jsp?curl=pages/about_us/general/general_content_000124.jsp&mid=WC0b01ac0580028e9e
- For frequently asked questions on the PIP procedure, see: European Medicines Agency (2014). Questions and answers on the procedure of PIP compliance verification at EMA, and on paediatric rewards. Retrieved 25 August, 2015 from http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/09/WC500003916.pdf
A2-1.18.4-v1.1