Last update: 13 Januar 2016
Einleitung
Die normale Entwicklung eines Arzneimittels bedarf der Durchführung verschiedener Studien, um seine Qualität, Sicherheit und Wirksamkeit sicherzustellen. Diese Studien wiederum erfordern sorgfältige Planungsverfahren, um auf jeden Fall ethisch und wissenschaftlich vertretbar zu sein. Während des Entwicklungsprozesses wird ein pädiatrisches Prüfkonzept verfasst, um sicherzustellen, dass die erforderlichen Daten für die Anwendung des Arzneimittels bei Kindern nur dann erhoben werden, wenn dies ungefährlich ist.
Pädiatrisches Prüfkonzept (PIP)
Das Ziel eines pädiatrischen Prüfkonzepts ist, die Genehmigung des Arzneimittels für Kinder zu unterstützen. Nachdem das Prüfkonzept zugelassen wurde, wird es mittels Änderungsverfahren auf dem neuesten Stand gehalten.
Ein pädiatrisches Prüfkonzept enthält Folgendes:
- Die Bedürfnisse aller Altersgruppen von Kindern von der Geburt bis zum Jugendalter und den zeitlichen Ablauf der Studien bei Kindern im Vergleich zu Erwachsenen. Es sollte die vollständige pädiatrische Altersgruppe abgedeckt werden, von begründeten Ausnahmen abgesehen.
- Überblick über die Krankheit, ihre Diagnose und Behandlung. Es sollten jegliche Unterschiede zwischen Kindern und Erwachsenen hervorgehoben werden.
- Überblick über die verfügbaren Daten für die Medizin, einschließlich:
- Chemischer Informationen über die aktuelle Formulierung
- Nicht-klinischer und klinischer Studiendaten
- Vorgeschlagene Strategie, einschließlich einiger oder aller der folgenden:
- Beschreibung der zusätzlichen nicht-klinischen Studien
- Pläne für eine pädiatrische Formulierung (falls erforderlich), einschließlich Maßnahmen zur Anpassung der Formulierung des Arzneimittels, um seine Anwendung bei Kindern akzeptabler zu machen, wie etwa die Anwendung einer flüssigen Formulierung statt großer Tabletten
- Eine Beschreibung der geplanten klinischen Studien oder Modellierung/Simulation (mit Computern, um vorherzusagen, wie das Medikament bei Kindern wirken kann), einschließlich:
- Einzelheiten über den zeitlichen Ablauf der Studien bei Kindern im Vergleich zum Entwicklungsplan bei Erwachsenen
- Werden die Studien bei Kindern nicht parallel durchgeführt, kann für die Fertigstellung des pädiatrischen Prüfkonzepts eine Verschiebung beantragt werden.
Das pädiatrische Prüfkonzept wird vom Antragsteller beim Pädiatrieausschuss (PDCO – Paediatric Committee) eingereicht. Die gesetzlichen Bestimmungen erfordern die Vorlage eines pädiatrischen Prüfkonzepts „spätestens bis zum Abschluss der pharmakokinetischen Studien an Erwachsenen”. Üblicherweise wird das pädiatrische Prüfkonzept eingereicht, sobald klinische Erfahrung bei Erwachsenen verfügbar ist. Wenn ein pädiatrisches Prüfkonzept abgeschlossen ist und pädiatrische Daten in der EU-Produktinformation enthalten sind, wird dies mit einer sechsmonatigen Verlängerung des ergänzenden Schutzzertifikats (SPC – Supplementary Protection Certificate) anerkannt.
Der EMA Pädiatrieausschuss (PDCO)
Der Pädiatrieausschuss (PDCO) beurteilt den Inhalt eines pädiatrischen Prüfkonzepts, alle Anfragen betreffend Verzichte und Verschiebungen, und bietet professionelle Analysen und eine kritische Überprüfung, um eine ‘Stellungnahme’ darüber abzugeben, ob das pädiatrische Prüfkonzept akzeptabel ist. Zu den Mitgliedern des PDCO zählen auch Patientenvertreter.
Auf Wunsch überprüft der Ausschuss Daten, die nach Zulassung des pädiatrischen Prüfkonzepts erzeugt wurden. Der Ausschuss pflegt außerdem Folgendes:
- Eine Liste von befreiungsfähigen Arzneimittelklassen oder Produkten
- Eine aktualisierte Bestandsaufnahme der etablierten pädiatrischen Bedürfnisse mittels gesammelter Daten.
Der Ausschuss verwendet diese Informationen, um europäische pädiatrische Forschungsnetzwerke bei Krankheiten zu beraten, die untersucht werden müssen, und bei denen pädiatrische Formulierungen bestehender Arzneimittel benötigt werden.
Die EU-Gesetzgebung wird kontinuierlich überprüft und überarbeitet, was die Gelegenheit dazu bietet, den Prozess der Einführung von Arzneimitteln für die Patienten zu optimieren. Ein Beitrag wird von allen Beteiligten gefordert, einschließlich der Ärzte, des medizinischen Fachpersonals, Pharmaunternehmen, Patienten und Patientenorganisationen.
Überblick über das PIP-Verfahren
- Ein pädiatrisches Prüfkonzept wird vom Pädiatrieausschuss der Europäischen Arzneimittel-Agentur bewertet und folgt einem festgelegten Verfahren mit festgelegten Fristen.
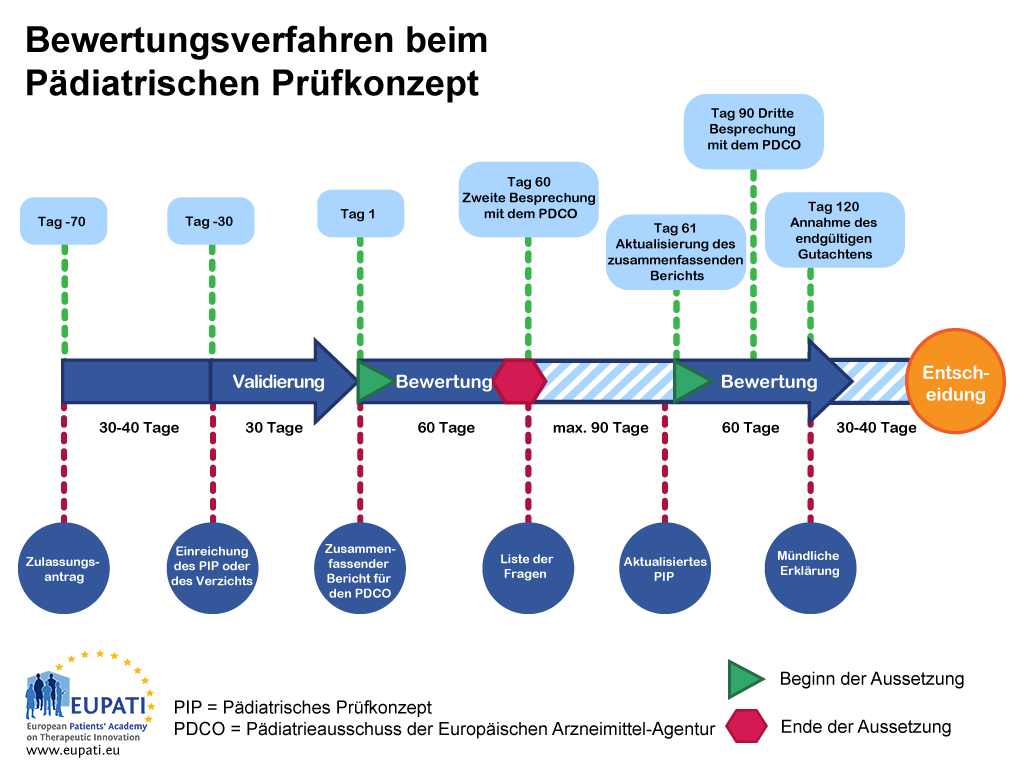
Das Verfahren bei einem pädiatrischen Prüfkonzept dauert 9 bis 10 Monate von der Einreichung bis zur Entscheidung. Nachdem der Antragsteller einen Zulassungsantrag eingereicht hat, ernennt der Pädiatrieausschuss einen 'Berichterstatter', um die Bewertung zu leiten und einen 'Gutachter', der die Qualität der Bewertung im Rahmen des Ausschusses überprüfen soll. Der Berichterstatter und der Gutachter überprüfen das ursprüngliche pädiatrische Prüfkonzept und legen ihre Erkenntnisse dem Pädiatrieausschuss vor.
Die Überprüfung erfolgt in Form eines 120-Tage-Verfahrens; jedoch gibt es eine Pause (Aussetzung) an Tag 60, die es dem Pädiatrieausschuss ermöglicht, dem Antragsteller Fragen zu stellen. Diese Aussetzungen sind in der Regel höchstens drei Monate lang, wobei die Länge im Einzelfall mit dem Pädiatrieausschuss vereinbart wird.
Sobald die Antworten des Antragstellers eingereicht wurden, wird die Zeit ab Tag 61 weitergezählt und das Verfahren läuft wieder ohne Pause, bis es an Tag 120 endet. Dies bedeutet, dass alle noch ausstehenden Fragen während des Verfahrens berücksichtigt werden müssen. Sollten nach dem dritten Gespräch mit dem Pädiatrieausschuss noch Fragen offen bleiben, kann der Pädiatrieausschuss oder der Antragsteller eine mündliche Erklärung beantragen. Dies ermöglicht es dem Antragsteller, direkt mit dem gesamten Ausschuss zu sprechen.
Befreiungen vom PIP
Der Sponsor kann von der Einreichung eines pädiatrischen Prüfkonzepts in folgenden Fällen befreit werden:
- Wenn das Arzneimittel bei Kindern wahrscheinlich unwirksam oder unsicher ist;
- wenn die Krankheit oder der Zustand nur bei Erwachsenen vorkommt; oder
- wenn der beobachtete „signifikante therapeutische Nutzen” zu gering ist oder es eine Begründung gibt, dass ein signifikanter therapeutischer Nutzen aufgrund von Durchführbarkeitsproblemen nicht nachgewiesen werden kann.
Es gibt drei Arten von Befreiungen:
- Klassenbefreiung – entsprechend einer vom Pädiatrieausschuss herausgegebenen Liste von Erkrankungen, die nur bei Erwachsenen vorkommen. Der Pädiatrieausschuss überlegt momentan die Beseitigung aller Klassenbefreiungen (diese betreffen überwiegend Krebserkrankungen)
- Vollständige Befreiung – für alle pädiatrischen Untergruppen und Indikationen
- Teilweise Befreiung – für eine oder mehrere pädiatrische Untergruppen und Indikationen
Eine Befreiung kann überprüft und geändert werden. Wird eine Befreiung widerrufen, gilt die Anforderung, Daten aus einem zugelassenen pädiatrischen Prüfkonzept vorzulegen, für 36 Monate nicht.
Weitergehende Informationen
- Für weiterführende Informationen zu Rollen im Pädiatrieausschuss, siehe: Europäische Arzneimittel-Agentur (2010). Rollen und Verantwortlichkeiten der Mitglieder und Stellvertreter, Berichterstatter und Gutachter, Sachverständigen und Beobachter des Pädiatrieausschusses (PDCO). Stand: 25. August 2015 von http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/10/WC500004754.pdf
- Für weiterführende Informationen zum Pädiatrieausschuss, siehe: Europäische Arzneimittel-Agentur (2015). PDCO: Übersicht. Stand: 25. August 2015, von http://www.ema.europa.eu/ema/index.jsp?curl=pages/about_us/general/general_content_000124.jsp&mid=WC0b01ac0580028e9e
- Für häufig gestellte Fragen zum PIP-Verfahren, siehe: Europäische Arzneimittel-Agentur (2014). Fragen und Antworten über das Verfahren der PIP-Konformitätsprüfung bei der EMA und über pädiatrische Prämien. Stand: 25. August 2015, von http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/09/WC500003916.pdf
A2-1.18.4-v1.1