Last update: 13 января 2016
Введение
Стандартная разработка лекарственного препарата требует проведения различных исследований, чтобы обеспечить качество, безопасность и эффективность препарата. Эти исследования, в свою очередь, требуют тщательного планирования процедур, чтобы обеспечить их соответствие этическим и научным принципам. Во время процесса разработки пишут план педиатрических исследований, чтобы обеспечить получение необходимых данных по применению лекарственного препарата у детей с сохранением безопасности.
План педиатрических исследований (ППИ)
Цель ППИ — содействие в регистрации лекарственных препаратов для применения у детей. После утверждения ППИ он продолжает обновляться на основании порядка изменений.
ППИ содержит следующее:
- Все необходимые группы пациентов, от рождения до подросткового возраста, и время проведения исследований у детей по сравнению со взрослыми. Необходимо охватить все возрастные группы детей, если нет других обоснований.
- Обзор природы заболевания, его диагностики и лечения. Необходимо подчеркнуть различия между детьми и взрослыми.
- Обзор доступных данных для лекарственного препарата, в том числе:
- информации о химическом строении на основании современных данных;
- данных доклинических и клинических исследований.
- Предполагаемую стратегию, включая некоторые или все перечисленные ниже пункты:
- Описание каких-либо дополнительных доклинических исследований.
- Планы относительно лекарственной формы для детей (если требуется), включая способы адаптации лекарственной формы препарата с целью сделать его применение более приемлемым у детей, например применение жидкой лекарственной формы вместо больших таблеток.
- Описание запланированных клинических исследований или моделирования/имитации (с помощью компьютеров, чтобы спрогнозировать возможное воздействие лекарственного препарата на детей), в том числе:
- Подробная информация о времени проведения исследований у детей по сравнению с планом разработки у взрослых.
- Если исследования у детей не завершаться одновременно с исследованиями у взрослых, для выполнения ППИ может потребоваться отсрочка.
ППИ подается заявителем в Педиатрический комитет (PDCO). Согласно требованиям законодательства подавать ППИ можно «не позднее завершения исследований фармакокинетики у взрослых людей». Обычно ППИ подается после получения клинических данных у взрослых. В случае выполнения ППИ и включения педиатрических данных в информацию о препарате для ЕС в качестве вознаграждения на шесть месяцев продлевается действие Свидетельства дополнительной охраны (СДО).
Педиатрический комитет EMA (PDCO)
Педиатрический комитет (PDCO) оценивает содержание ППИ, все прошения об освобождении и отсрочке и предоставляет экспертный анализ и критическое мнение, чтобы принять решение с целью определения приемлемости данного ППИ. В состав PDCO входят представители пациентов.
По требованию комитет оценивает полученные данные после утверждения ППИ. Кроме того, у них хранится:
- список продукции и классов лекарственных препаратов, являющихся исключением;
- обновленный перечень установленных потребностей для детей на основании собранных данных.
Они используют эту информацию, чтобы консультировать европейские научные педиатрические сообщества по заболеваниям, требующим изучения, и в случае необходимости разработки лекарственных форм для детей для существующих препаратов.
Законодательство ЕС постоянно проверяется и пересматривается, что предоставляет возможность для оптимизации процесса получения пациентами лекарственных препаратов. Требуется вклад всех заинтересованных сторон, в том числе врачей, квалифицированных медицинских работников, фармацевтических компаний, пациентов и ассоциаций пациентов.
Обзор процедуры ППИ
- План педиатрических исследований оценивается Педиатрическим комитетом Европейского агентства по лекарственным средствам и рассматривается в установленном порядке в определенные временные рамки.
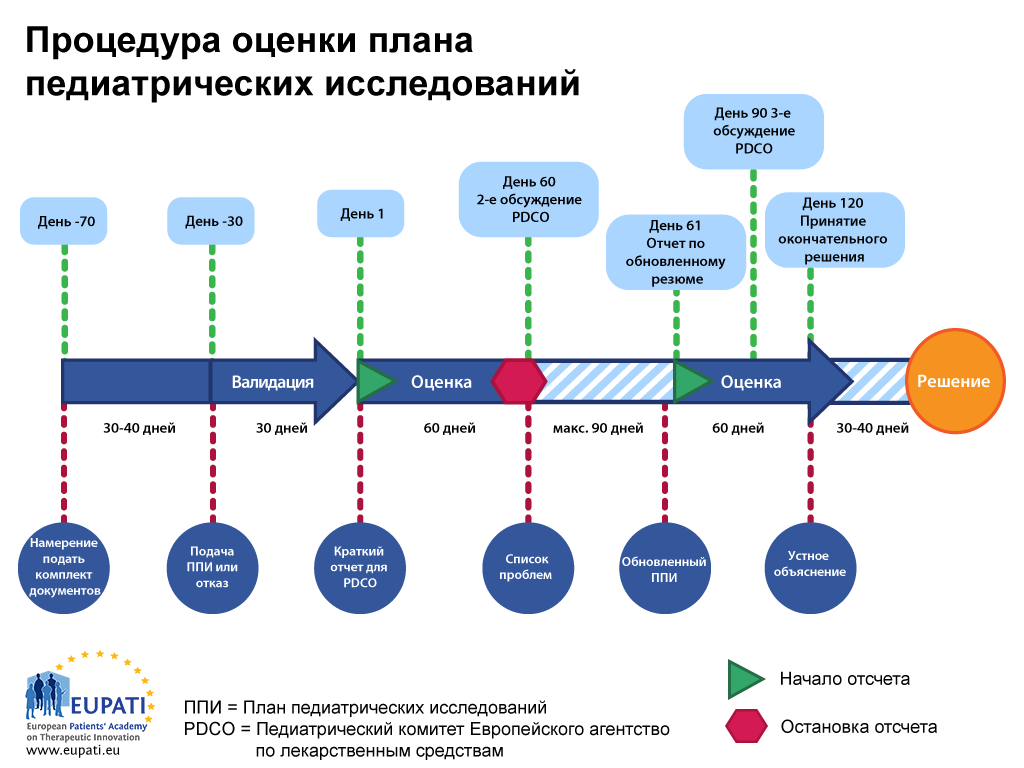
Процедура ППИ занимает 9–10 месяцев с момента подачи до принятия решения. После запроса заявителя относительно «намерения подать комплект документов» PDCO назначает «докладчика», который возглавляет оценку, и «независимого эксперта» для проверки качества оценки из членов комитета. Докладчик и независимый эксперт проверяют первоначальный ППИ и представляют свои результаты для членов PDCO.
Процесс проверки представляет собой процедуру, занимающую 120 дней; однако через 60 дней предусмотрена пауза (остановка отсчета), которая позволяет членам PDCO задавать вопросы заявителю. Эти остановки отсчета обычно не превышают трех месяцев, хотя их продолжительность устанавливается PDCO индивидуально.
После получения ответов заявителя отчет продолжается со дня 61, и процедура уже проводится без остановок до своего завершения в день 120. Это означает, что во время процедуры необходимо решить все спорные вопросы. Если какие-либо вопросы остаются спорными после третьего обсуждения PDCO, тогда PDCO или заявитель может потребовать устных объяснений. Это позволяет заявителю непосредственно поговорить со всеми членами комитета.
Освобождение от подачи ППИ
Спонсор может освобождаться от подачи ППИ в таких случаях:
- лекарственный препарат, вероятно, неэффективен или небезопасен для детей;
- заболевание или состояние возникает только у взрослых; или
- отсутствуют видимые «значимые терапевтические преимущества» либо согласно оценке существуют касающиеся целесообразности проблемы, свидетельствующие о невозможности продемонстрировать значимые терапевтические преимущества.
Существует три типа такого освобождения:
- Классовое освобождение – в соответствии с подготовленным PDCO списком состояний, которые возникают только у взрослых. В данное время PDCO рассматривает возможность устранения всех классовых освобождений (в основном связанных со злокачественными новообразованиями).
- Полное освобождение – для всех подгрупп детей и показаний.
- Частичное освобождение – для одной или более подгрупп детей и одного или более показания.
Предоставление освобождения может пересматриваться и изменяться. Если освобождение отменяется, в течение 36 месяцев не предъявляется требование подать данные в соответствии с согласованным ППИ.
Дополнительные источники
- Для получения дополнительной информации о функциях PDCO см.: Европейское агентство по лекарственным средствам (2010). Функции и обязанности членов и заместителей, докладчиков и независимых экспертов, экспертов и наблюдателей в Педиатрическом комитете (PDCO). Источник по состоянию на 25 августа 2015 г.: http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/10/WC500004754.pdf
- Для получения дополнительной информации о PDCO см.: Европейское агентство по лекарственным средствам (2015). PDCO: Обзор. Источник по состоянию на 25 августа 2015 г.: http://www.ema.europa.eu/ema/index.jsp?curl=pages/about_us/general/general_content_000124.jsp&mid=WC0b01ac0580028e9e
- Для ознакомления с часто задаваемыми вопросами по процедуре ППИ см.: Европейское агентство по лекарственным средствам (2014). Вопросы и ответы относительно процедуры подтверждения соблюдения ППИ требований в EMA и поощрений в области педиатрии. Источник по состоянию на 25 августа 2015 г.: http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/09/WC500003916.pdf
A2-1.18.4-v1.1