Last update: 17 czerwca 2015
Istnieją nowe obszary badań w medycynie spersonalizowanej stymulujące jej rozwój:
Genetyka molekularna
Bieżące badania dostarczają wielu informacji o chorobach na poziomie komórkowym i molekularnym. Istnieją dowody, że określone zmiany w genach (wariancje) mogą wpływać na działanie komórek i rozwój choroby. Choroby o podobnych objawach mogą być rozpoznawane jako taka sama choroba. Mogą jednak być spowodowane przez różne wariancje genetyczne.
Epigenetyka
Ta rozwijająca się dziedzina umożliwia poznanie zmienności dotyczącej choroby. Epigenetyka zajmuje się badaniem sposobów włączania lub wyłączania genów, lub ich modulowania (zwiększania lub zmniejszania ekspresji) bez zmian w ich sekwencji DNA. Zmiany epigenetyczne mogą wpływać na sposób reagowania pacjenta na leczenie, ponieważ mogą wystąpić jako reakcja na czynniki środowiskowe lub związane ze stylem życia, takie jak narażenie na promieniowanie UV, dieta, palenie tytoniu lub stres. Finalnie, medycyna spersonalizowana będzie brać pod uwagę cechy epigenetyczne jednostki.
Opracowywanie biomarkerów i leków
Procesy zachodzące na poziomie komórkowym i molekularnym można mierzyć za pomocą „biomarkerów”. Oto kilka przykładów biomarkerów:
- Pomiary fizjologiczne, takie jak ciśnienie krwi czy temperatura
- substancje biologiczne („substancje biochemiczne”), takie jak enzymy czy hormony
- zmiany w genach
- obrazy uzyskane metodą rezonansu magnetycznego (MRI)
Biomarkery są coraz częściej wykorzystywane w czasie opracowywania leków, co ma umożliwić utworzenie terapii celowanych. Oczekuje się, że efektem będzie:
- poprawa wyników pacjentów: lekarze powinni mieć możliwość wyboru leków działających dobrze u każdej osoby i stwarzających niewielkie ryzyko wystąpienia ciężkich działań ubocznych
- poprawa skuteczności opracowywania leków, zwiększająca efektywność badań przedklinicznych i klinicznych, a także skracająca ich czas i zwiększająca bezpieczeństwo
Farkmakogenetyka lub farmakogenomika
Jeden rodzaj biomarkera, który staje się szeroko używany, stanowi informację genetyczną lub genomiczną dotyczącą człowieka. Badania wpływu genetyki i genomiki na reakcję człowieka na leczenie określa się jako farmakogenetykę i farmakogenomikę. Pomagają one dostosować leczenie do genetycznej konfiguracji osoby. Wiele leków obecnych obecnie na rynku wymaga przeprowadzenia badań genetycznych przed przepisaniem ich pacjentowi, aby zagwarantować bezpieczeństwo leczenia w konkretnym przypadku. Na przykład:
- Pacjenci z wirusem HIV są badani pod kątem wariancji znanej jako „HLA B*5701” przed przepisaniem abakawiru, ponieważ ta wariancja jest skojarzona z reakcją niepożądaną na lek.
Ponadto informacje, którymi są opatrzone niektóre inne leki na rynku, zawierają zalecenia dla lekarzy dotyczące sposobu wykorzystania danych genomicznych pacjenta podczas przepisywania leku. Informacje genomiczne mogą pomóc zdecydować, czy dany lek jest najlepszą możliwością dla pacjenta, i jaka powinna być najlepsza dawka. Na przykład:
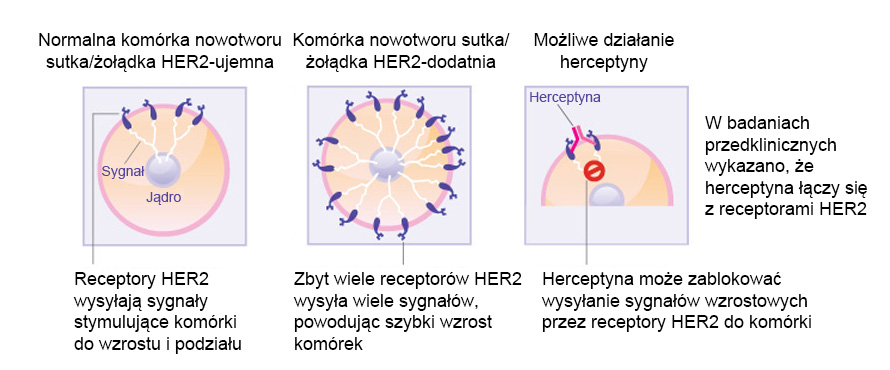
Trastuzumab (Herceptyna) to monoklonalne przeciwciała nastawione na geny, nakierowane przeciwko czynnikowi wzrostu naskórka ludzkiego (HER-2), przyjęte w leczeniu wczesnych stadiów nowotworu piersi. Nadekspresja receptora HER-2 występuje w przypadku około 20 % raka sutka, powodując nadmierne przesyłanie sygnałów do wnętrza komórki, co pobudza komórki raka do coraz szybszego rozwoju. Z leczenia za pomocą trastuzumabu mogą skorzystać tylko pacjenci, u których wykryto wysokie poziomy receptora HER-2 Receptor HER-2 znajduje się na powierzchni niektórych komórek raka sutka i jest kierowany do błony komórkowej. Trastuzumab działa poprzez przyczepienie się do receptora HER-2 na powierzchni komórek nowotworowych piersi oraz blokowanie otrzymywania przez nie sygnałów wzrostu. Poprzez blokowanie sygnałów, trastuzumab może zwolnić lub zatrzymać rozrost nowotworu piersi oraz stanowi przykład terapii celowanej immunologicznie.
- Wpływ herceptyny na komórki raka piersi. (Źródło: patrz piśmiennictwo 1).
Biobanki
Badania z wykorzystaniem biobanków są szczególnie ważne dla rozwoju medycyny spersonalizowanej, a ich wykorzystanie w badaniach klinicznych nowych leków stale rośnie. Zasadniczo biobanki są wielkimi, uporządkowanymi zbiorami próbek krwi lub tkanek; dawcami są pacjenci lub zdrowi ochotnicy. W biobankach znajdują się także starannie gromadzone dane o stanie klinicznym dawców, stylu życia (dieta, palenie tytoniu) i innych czynnikach. Biobanki umożliwiają badanie komórek i cząsteczek pochodzących z wielu próbek. Uzyskane w ten sposób informacje można łączyć z danymi klinicznymi i innymi. Taki sposób łączenia informacji pozwala lepiej zrozumieć:
- różnice między osobami powodujące zachorowanie lub nie na daną chorobę
- różnice między ciężkością choroby u różnych osób
- różnice odpowiedzi różnych osób na leczenie.
Im więcej próbek jest dostępnych, tym większa może okazać skuteczność takich badań. Biobanki są zakładane w wielu krajach. „EuroBioBank” stanowi przykład połączenia biobanków z różnych krajów, aby udostępnić do badań jeszcze więcej danych (w tym wypadku danych dotyczących rzadkich chorób).
Piśmiennictwo
- How Herceptin affects breast cancer cells” by beyondthedish.wordpress.com is licensed under a Creative Commons Attribution-NonCommercial-NoDerivs 3.0 Unported License.
See: https://beyondthedish.wordpress.com/2012/06/04/smart-bomb-successfully-treat-advanced-breast-cancer-in-clinical-trials/
A2-1.08.2-V1.6