Last update: 17 juni 2015
Der er nye forskningsområder, der fremmer udviklingen af personlig medicin:
Molekylær genetik
Den nuværende forskning siger meget om sygdomme på celle- og molekyleniveau. Der er evidens for, at specifikke forandringer i gener (variationer) kan påvirke den måde, celler fungerer på, og hvordan en sygdom kan udvikle sig. Sygdomme med lignende symptomer bliver måske diagnosticeret som den samme sygdom. Det kan dog være, at de forårsages af forskellige genetiske variationer.
Epigenetik
Dette område er i vækst, og det hjælper os med at forstå variationer i sygdomme. Epigenetik er studiet af, hvordan gener kan aktiveres eller deaktiveres eller moduleres (skrues op eller ned) uden forandringer i deres DNA-sekvenser. Epigenetiske forandringer kan påvirke, hvordan en patient reagerer på en behandling, da forandringerne kan opstå som reaktion på miljømæssige faktorer eller livsstilsfaktorer, f.eks. eksponering over for UV-lys, kost, rygning eller stress. I sidste ende skal personlig medicin tage højde for en persons epigenetik.
Biomarkører og udvikling af lægemidler
Processer, der foregår på celle- og molekyleniveau, kan identificeres ved hjælp af “biomarkører”. Nogle eksempler på biomarkører er:
- Fysiologiske målinger som f.eks. blodtryk eller temperatur
- biologiske stoffer (“biokemikalier”) som f.eks. enzymer eller hormoner
- genforandringer
- billeder fra MR-scanning
For at udvikle målrettede behandlinger bruges biomarkører i stigende grad til udvikling af lægemidler. Dette forventes at:
- forbedre resultaterne for patienter: læger skal kunne vælge lægemidler, der virker godt for hver enkelt patient og giver en lavere risiko for alvorlige bivirkninger
- forbedre effektiviteten i udviklingen af lægemidler, så prækliniske og kliniske forsøg udføres mere effektivt, på kortere tid og på mere sikker vis
Farmakogenetik eller farmakologisk genombiologi
En biomarkørtype, der bliver mere og mere udbredt, er oplysninger om en persons genetik eller genom. Studiet af, hvordan genetik og genom påvirker en persons reaktion på en behandling er kendt som farmakogenetik eller farmakologisk genombiologi. De er med til at “skræddersy en behandling” i overensstemmelse med en persons genetiske konfiguration. Et antal lægemidler på markedet i dag kræver, at der foretages en genetisk test, før lægemidlet ordineres, for at sørge for, at behandlingen er sikker at bruge for den enkelte patient. F.eks.:
- HIV-patienter testes for en genetisk variation, der er kendt som “HLA B*5701”, før lægemidlet abacavir ordineres, fordi denne variation har sammenhæng med en bestemt bivirkning.
Derudover giver de oplysninger, der følger med visse andre lægemidler på markedet, lægerne gode idéer om, hvordan en patients genombiologiske oplysninger kan anvendes, når der skal ordineres et lægemiddel. Genombiologiske oplysninger kan hjælpe med at bestemme, om lægemidlet er den bedste mulighed for den pågældende patient, og hvad der er den bedste dosis. F.eks.:
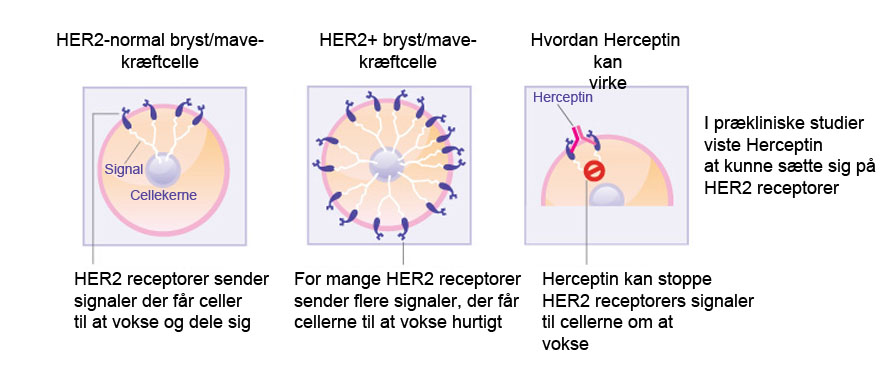
Trastuzumab (Herceptin) er genmålrettet monoklonalt antistof rettet mod HER-2 (epidermal vækstfaktor Receptor-2 i mennesker) og godkendt til behandling af de brystkræft på de tidlige stadier. HER-2 er overudtrykt i ca. 20 % af brystkræfttilfælde, hvilket forårsager for kraftige signaler til cellens indre og får brystkræftcellerne til at vokse hurtigere og hurtigere. Kun patienter, der er testet positive for høje niveauer af HER-2, har gavn af behandling med trastuzumab. HER-2 findes på overfladen af nogle brystkræftceller og ledes ind i cellemembranen. Trastuzumab virker ved at hægte sig fast på HER-2 på overfladen af brystkræftceller og forhindre dem i at modtage vækstsignaler. Ved at blokere signalerne kan trastuzumab forsinke eller stoppe væksten af brystkræft, og det er dermed et eksempel på en immunfokuseret behandling.
- Hvordan Herceptin påvirker brystkræftceller (Kilde: beyondthedish.wordpress.com). Prækliniske studier viser at Herceptin kan virke på brystkræft eller mavekræftceller ved at blokere HER2 receptorer og forhindre dem i at stimulere cellevækst og deling.
Biobanker
Undersøgelser, der bruger biobanker, er især vigtige for udviklingen af personlig medicin, og biobanker bruges i stigende grad i kliniske forsøg i forbindelse med nye lægemidler. Biobanker er i bund og grund store, organiserede arkiver med blod- og/eller vævsprøver, der er doneret af patienter og raske frivillige. De indeholder også omhyggeligt indsamlede data om donorernes kliniske tilstand, livsstil (kost, rygning osv.) og andre faktorer. Biobanker giver mulighed for at undersøge celler og molekyler i et stort antal prøver, ligesom disse oplysninger kan sammenkædes med kliniske data og andre data. Ved at kombinere oplysninger på denne måde kan vi få en forståelse af, hvorfor der er variationer mellem forskellige mennesker:
- i de sygdomme, som de udvikler
- i, hvor alvorlige deres sygdomme er, og
- i, hvordan de reagerer på behandling.
Jo flere tilgængelige prøver der er, desto mere effektive kan disse undersøgelser blive. Man er i gang med at etablere biobanker i mange lande. "EuroBioBank" er et eksempel på biobanker fra forskellige lande, der sammenkædes, så endnu flere data bliver tilgængelige for forskning (i dette tilfælde i sjældne sygdomme).
Referencer
- How Herceptin affects breast cancer cells” by beyondthedish.wordpress.com is licensed under a Creative Commons Attribution-NonCommercial-NoDerivs 3.0 Unported License.
See: https://beyondthedish.wordpress.com/2012/06/04/smart-bomb-successfully-treat-advanced-breast-cancer-in-clinical-trials/
A2-1.08.2-V1.6