Last update: 17 juni 2015
Er zijn diverse nieuwe onderzoeksterreinen die gepersonaliseerde geneeskunde bevorderen:
Moleculaire genetica
Recent onderzoek leert ons veel over ziekten op cellulair en moleculair niveau. Er zijn aanwijzingen dat specifieke veranderingen in genen (variaties) van invloed kunnen zijn op de manier waarop cellen functioneren en hoe een ziekte zich kan ontwikkelen. Ziekten met vergelijkbare symptomen kunnen als dezelfde ziekte worden gediagnosticeerd. Ze kunnen echter door verschillende genetische variaties worden veroorzaakt.
Epigenetica
Dit zich ontwikkelende terrein/ gebied helpt ons de variatie in ziekten te begrijpen. Epigenetica is het onderzoek naar hoe genen kunnen worden aan – en uitgezet, of ingesteld (omhoog of omlaag) zonder veranderingen in hun DNA-sequentie. Epigenetische veranderingen kunnen invloed hebben op de manier waarop een patiënt op een behandeling reageert,aangezien de veranderingen kunnen optreden als reactie op omgevings- of leefstijlfactoren, zoals blootstelling aan uv-licht, voeding, roken of stress. Uiteindelijk zal gepersonaliseerde geneeskunde rekening houden met de epigenetica van het individu.
Biomarkers en geneesmiddelenontwikkeling
Processen die op cellulair en moleculair niveau verlopen, kunnen met behulp van of aan de hand van van ‘biomarkers’ worden gemeten. Enkele voorbeelden van biomarkers zijn:
- fysiologische maten als bloeddruk of lichaamstemperatuur
- biologische stoffen (‘biochemicaliën’), zoals enzymen of hormonen
- genveranderingen
- beelden verkregen door middel van magnetische kernspinresonantie (MRI)
Om gerichte behandelingen te ontwikkelen wordt bij de ontwikkeling van geneesmiddelen in toenemende mate gebruikgemaakt van biomarkers. Dit leidt naar verwachting tot:
- verbetering van uitkomsten voor patiënten: artsen moeten geneesmiddelen kunnen kiezen die voor elk individu goed werken en met een lager risico op ernstige bijwerkingen
- verbetering van de doeltreffendheid van geneesmiddelenontwikkeling, waardoor niet-klinische en klinische onderzoeken efficiënter, minder tijdrovend en veiliger worden
Farmacogenetica of farmacogenomica
Eén type biomarker die steeds vaker wordt gebruikt, is iemands genetische of genomische informatie. Het onderzoek naar hoe genetica of genomica (‘genomics’) van invloed is op iemands respons op een behandeling wordt farmacogenetica en farmacogenomica genoemd. Met behulp hiervan kan een behandeling worden ‘afgestemd’ op de genetische samenstelling van een individu. Diverse geneesmiddelen die vandaag de dag op de markt zijn, vereisen een genetische test voordat het geneesmiddel wordt voorgeschreven om zeker te zijn dat de behandeling veilig is voor de individuele patiënt. Bijvoorbeeld:
- hiv-patiënten worden voordat het geneesmiddel abacavir wordt voorgeschreven, getest op een genetische variatie genaamd ‘HLA B*5701’ omdat de variatie gepaard gaat met een bijwerking op het geneesmiddel.
Bovendien wordt in de informatie die wordt verstrekt bij enkele andere geneesmiddelen die op de markt zijn, artsen geadviseerd hoe de genomische informatie van een patiënt moet worden gebruikt bij het voorschrijven van het geneesmiddel. Genomische informatie kan helpen beslissen of dit geneesmiddel de beste optie is voor die patiënt en wat de beste dosis zou zijn. Bijvoorbeeld:
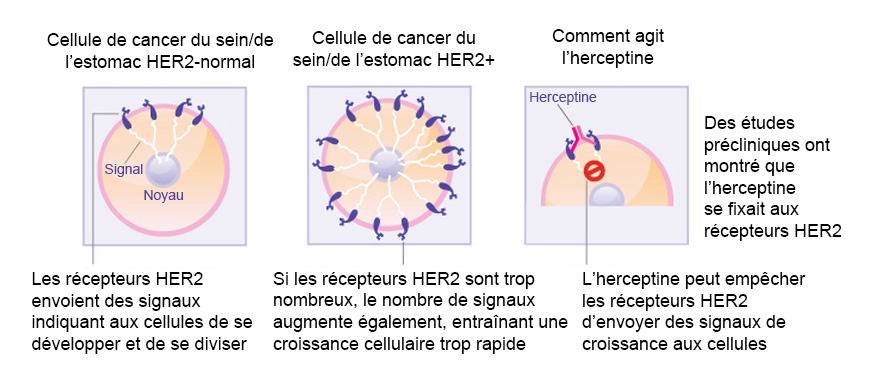
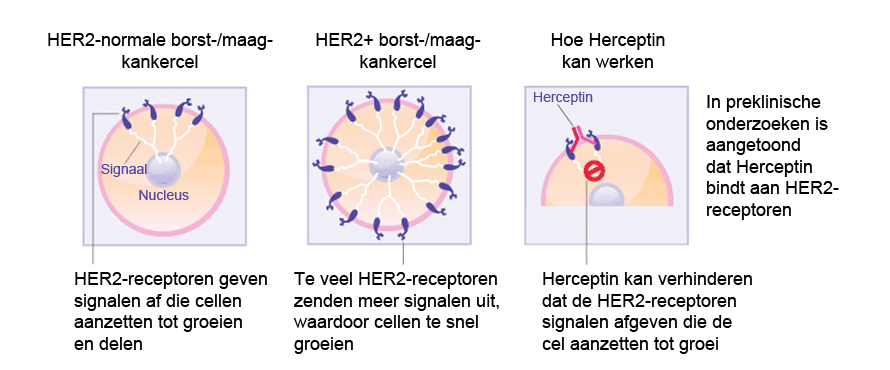
Herceptin is een gengericht monoklonaal antilichaam tegen de humane epidermale groeifactorreceptor-2 (HER-2) en is goedgekeurd voor de behandeling van borstkanker in een vroeg stadium. In ongeveer 20% van de gevallen van borstkanker wordt HER-2 overmatig tot expressie gebracht, resulterend in een te sterke signalering naar het inwendige van de cel waardoor de borstkankercellen steeds sneller gaan groeien. Alleen patiënten die positief testen op hoge HER-2-spiegels, zullen baat hebben bij een behandeling met Herceptin. HER-2 komt voor op het oppervlak van sommige borstkankercellen en is ingebouwd in de celmembraan. Herceptin hecht aan het HER-2 op het oppervlak van borstkankercellen en blokkeert de overdracht van groeisignalen op de cellen. Door blokkering van de signalen kan Herceptin de groei van de borstkanker afremmen of stopzetten; Herceptin is een voorbeeld van een immuungerichte therapie.
- Comment l’herceptine agit sur les cellules cancéreuses du sein : (Source: see reference 1)
- Hoe Herceptin borstkankercellen aanpakt (Bron: zie referentie 1)
Biobanken
Onderzoeken waarin gebruik wordt gemaakt van biobanken, zijn in het bijzonder belangrijk voor de ontwikkeling van gepersonaliseerde geneeskunde, en biobanken worden in toenemende mate gebruikt in klinische onderzoeken naar nieuwe geneesmiddelen. Biobanken zijn in principe grote, georganiseerde reeksen van bloed- en/of weefselmonsters, afgestaan door patiënten en gezonde vrijwilligers. Ze bevatten ook zorgvuldig verzamelde gegevens over de klinische toestand, leefstijl (voeding, roken enz.) en andere factoren van de donoren. Biobanken maken het mogelijk de cellen en moleculen van grote aantallen monsters te bestuderen en deze informatie te koppelen aan klinische en andere gegevens. Door informatie op deze manier te combineren begrijpen we beter waarom mensen verschillen in:
- welke ziekten zich bij hen ontwikkelen
- hoe ernstig hun ziekten zijn en
- hoe ze op een behandeling reageren.
Hoe meer monsters er beschikbaar zijn, hoe effectiever dergelijke onderzoeken kunnen zijn. Biobanken worden in veel landen opgezet. ‘EuroBioBank’ is een voorbeeld waarbij biobanken van verschillende landen gekoppeld zijn waardoor er nog meer gegevens beschikbaar komen voor wetenschappelijk onderzoek (in dit geval naar zeldzame ziekten).
Referenties
- “How Herceptin affects breast cancer cells” van beyondthedish.wordpress.com valt onder de licentie van Creative Commons Attribution-NonCommercial-NoDerivs 3.0 niet-aangepaste licentie.
Zie: https://beyondthedish.wordpress.com/2012/06/04/smart-bomb-successfully-treat-advanced-breast-cancer-in-clinical-trials/
A2-1.08.2-V1.6