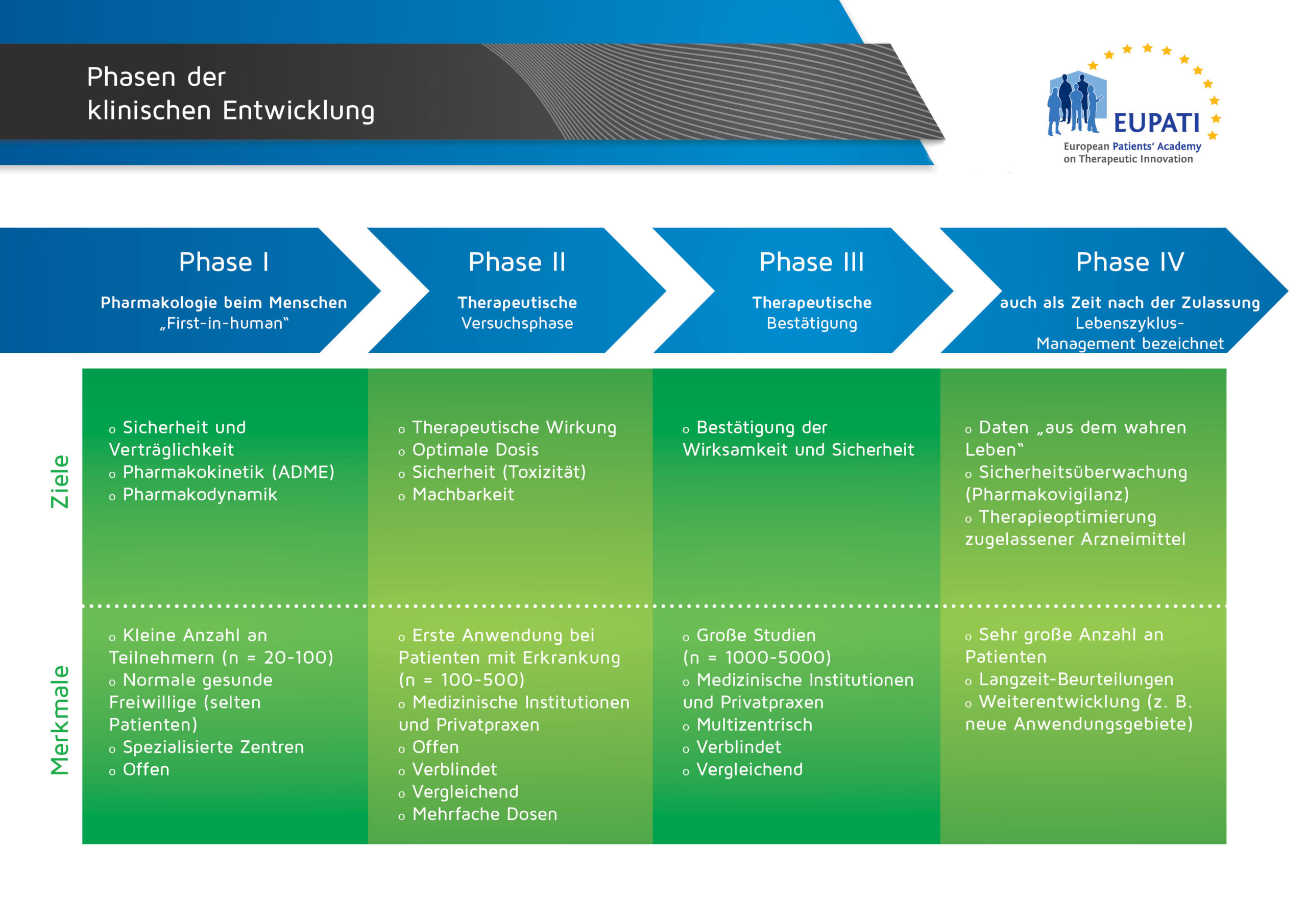
Phase-II-Studien
« Zurück zum Glossar-IndexPhase-II-Studien sind in der Regel die ersten Studien an Patienten mit einem neuen Arzneimittel. Normalerweise nimmt nur eine kleine Anzahl von Patienten teil, die genau überwacht werden. Diese Studien sind oft größer als Phase-I-Studien.
Phase-II-Studien werden durchgeführt, um festzustellen, ob das Arzneimittel positive Auswirkungen auf die betreffende Erkrankung hat. Dabei kann das neue Arzneimittel mit einer bestehenden Behandlung oder einem Placebo verglichen werden. Diese Studien dienen auch dazu, um den optimalen Dosisbereich zu bestimmen und zu ermitteln, wie oft das Arzneimittel verabreicht werden soll und wie am besten mit Nebenwirkungen umzugehen ist.
Ein neues Arzneimittel muss bestimmte vorgegebene Anforderungen erfüllen, bevor es in Phase-III-Studien getestet werden kann. Phase-I-, Phase-II- und Phase-III-Studien werden als klinische Entwicklung bezeichnet.
- Die vier Phasen der klinischen Entwicklung unterscheiden sich in Bezug auf ihre Ziele und Merkmale.