Last update: 23 listopada 2015
Wprowadzenie
Tematem tego artykułu jest prawodawstwo Unii Europejskiej (UE) i wytyczne Europejskiej Agencji Leków (EMA). Nie uwzględniono w nim kwestii prawodawstwa narodowego lub wytycznych poza UE. Role organizacji pacjentów są opisane na poziomie EMA.
Europejska Agencja Leków (EMA)
Europejska Agencja Leków (EMA) odpowiada za naukową ocenę wniosków o pozwolenie na dopuszczenie do obrotu w Unii Europejskiej produktów leczniczych przeznaczonych dla ludzi i zwierząt.
Od czasu założenia w 1995 roku EMA angażuje się w dialog z europejskimi pacjentami i konsumentami. Jako stosujący leki oceniane przez EMA, pacjenci są głównymi osobami zainteresowanymi pracą Agencji i mogą jej służyć szczególną wiedzą i doświadczeniem.
Pacjenci i konsumenci są zaangażowani w EMA w wiele działań, począwszy od recenzowania przygotowanych przez EMA informacji na temat leków, po udział w przygotowaniu wytycznych, pracę w naukowych grupach doradczych i uczestnictwo w pracach komitetów naukowych EMA.
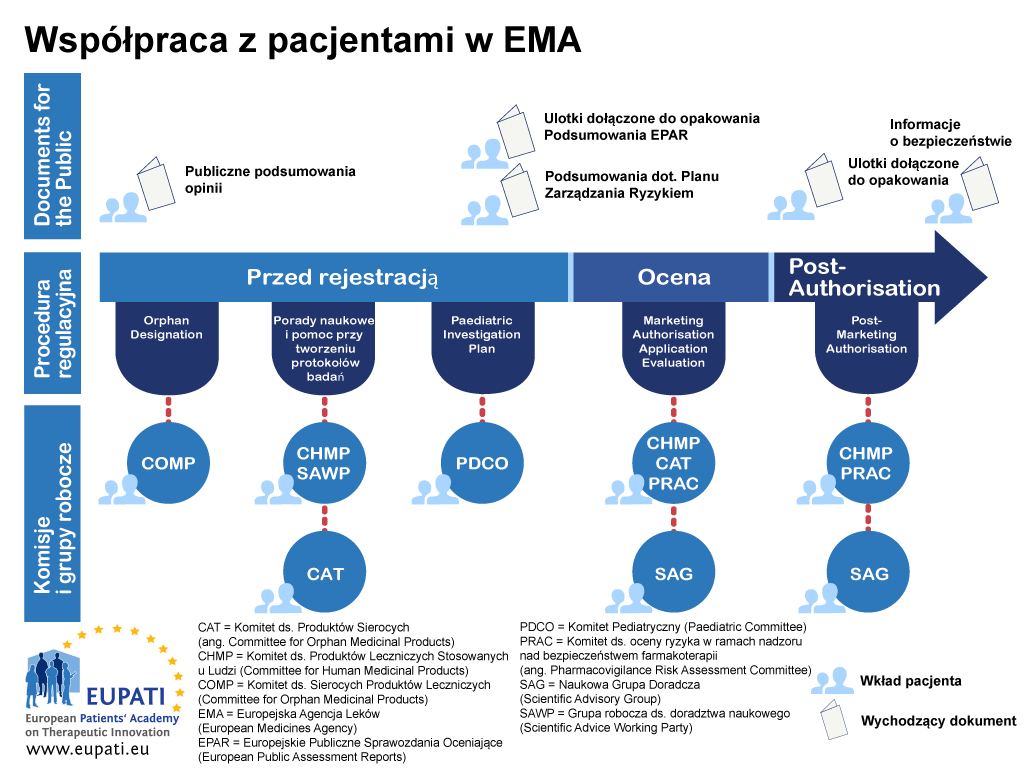
Zaangażowanie pacjentów w prace komitetów regulacyjnych EMA
Do chwili obecnej wdrożenie prawodawstwa wspólnotowego doprowadziło do obecności pacjentów w czterech komitetach naukowych EMA. Są to: Komitet ds. Produktów Sierocych (ang. Committee for Orphan Medicinal Products, COMP), Komitet Pediatryczny (ang. Paediatric Committee, PDCO), Komitet ds. Terapii Zaawansowanych (ang. Committee for Advanced Therapies, CAT) i Komitet ds. oceny ryzyka w ramach nadzoru nad bezpieczeństwem farmakoterapii (ang. Pharmacovigilance Risk Assessment Committee, PRAC). Pacjenci są także reprezentowani w Zarządzie EMA.
- Pacjenci mogą brać udział w działaniach EMA w trakcie procedury rejestracyjnej w różny sposób.
Komitet ds. Sierocych Produktów Leczniczych (ang. Committee for Orphan Medicinal Products, COMP)
Trzech członków reprezentujących organizacje pacjentów, nominowanych przez Komisję Europejską na trzyletnią odnawialną kadencję, zasiada w COMP od pierwszego jego posiedzenia w kwietniu 2000 roku.
Komitet Pediatryczny (ang. Paediatric Committee, PDCO)
Od września 2008 roku w PDCO zasiada trzech członków i trzech zastępców reprezentujących organizacje pacjentów, wskazanych przez Komisję Europejską na trzyletnią odnawialną kadencję.
Komitet ds. Terapii Zaawansowanych (ang. Committee for Advanced Therapies, CAT)
Od stycznia 2009 roku w CAT zasiada dwóch członków i dwóch zastępców reprezentujących stowarzyszenia pacjentów, wskazanych przez Komisję Europejską na trzyletnią odnawialną kadencję.
Komitet ds. oceny ryzyka w ramach nadzoru nad bezpieczeństwem farmakoterapii (ang. Pharmacovigilance Risk Assessment Committee, PRAC)
Od lipca 2012 roku w PRAC zasiada jeden członek i jeden zastępca reprezentujący stowarzyszenia pacjentów, wskazany przez Komisję Europejską na trzyletnią odnawialną kadencję.
Rola i wartość pacjentów jako członków komitetów naukowych
Pacjenci będący członkami komitetów naukowych EMA działają tak samo, jak inni członkowie. Doświadczenie pokazuje, że pacjenci bardzo często wnoszą wkład naukowy w toczące się dyskusje. Wartością dodaną wynikającą z włączenia pacjentów i konsumentów do komitetów naukowych jest ich wyjątkowy i znaczący wkład, którego źródłem są rzeczywiste doświadczenia z leczenia i jako osób chorych. Aktywność pacjentów powinna skupiać się na przekazywaniu tych unikalnych doświadczeń tak, aby wszystkie prace komitetów i ich wyniki uwzględniały tę wyjątkową perspektywę.
Wszyscy członkowie komitetu:
- Uczestniczą w jej działaniach zgodnie z zasadami proceduralnymi i zdefiniowanymi zadaniami
- Zachowują poufność, deklarują brak konfliktu interesów i przestrzegają kodeksu postępowania EMA
- Biorą udział w podejmowaniu przez komitet decyzji i mają równe prawo głosu. Zastępcy mogą uczestniczyć we wszystkich posiedzeniach i na równych prawach brać udział w pracach i dyskusjach komitetu.
Inne materiały
- European Medicines Agency (2014). EMA/652164/2014 Annex II: Aktywności EMA, w które zaangażowani są pacjenci* i konsumenci. Pobrano 31 sierpnia 2015 r. ze strony http://www.ema.europa.eu/docs/en_GB/document_library/Other/2014/12/WC500179568.pdf
- Europejska Agencja Leków (2014). EMA/24913/2005 – rev. 2. Kryteria, które muszą spełnić organizacje pacjenckie i konsumenckie zaangażowane w prace Europejskiej Agencji Leków (EMA). Pobrano 4 września 2015 r. ze strony http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/12/WC500018099.pdf
- Europejska Agencja Leków (2013). EMA/272219/2013 Szósty raport roczny dotyczący zaangażowania organizacji pacjenckich i konsumenckich (2012). Pobrano 4 września 2015 r. ze strony http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/12/WC500018099.pdf
Załączniki
A2-5.08.1-v1.3