Last update: 23 novembre 2015
Introduction
Dans la méthodologie traditionnelle des essais cliniques, chaque nouveau traitement doit suivre un processus de développement strict. Une fois les essais de phase I réussis, un essai de phase II doit être conduit pour démontrer que l’efficacité et la sécurité du médicament sont suffisantes. Puis, le médicament fait l’objet d’essais de phase III, où il est comparé à un traitement standard (dit de contrôle). Ce processus appliqué à chaque traitement nécessite beaucoup de temps, un grand nombre de patients et des ressources financières substantielles. En outre, dans l’approche traditionnelle, aucune modification n’est autorisée pendant l’essai.
La méthodologie adaptative est une nouvelle approche des essais cliniques. Les essais cliniques adaptatifs offre la possibilité de planifier à l’avance la modification d’un ou de plusieurs aspects de l’essai. Ces modifications sont généralement basées sur l’analyse des données intermédiaires des participants pendant l’essai.
Les méthodologies adaptatives (ou schémas adaptatifs) sont utilisées dans les essais cliniques pour de nombreuses raisons. Dans un environnement soumis à des contraintes économiques, les méthodologies adaptatives peuvent être attrayantes pour l’industrie pharmaceutique, les scientifiques, les médecins et les patients.
Méthodologies adaptatives
Les méthodologies adaptatives sont relativement flexibles, car elles permettent de procéder à des modifications pendant l’essai afin de rationaliser et d’optimiser le processus. Les analyses des données accumulées sont réalisées au cours de l’étude à des moments prédéterminés, en insu total ou non, et avec ou sans test formel de l’hypothèse statistique. Il est important que la modification du processus ne compromette pas la validité et l’intégrité de l’essai.
Les méthodologies adaptatives peuvent poser des problèmes opérationnels du fait de leur complexité et le processus d’adaptation d’un essai peut introduire un biais. Ce biais peut être statistique ou opérationnel : par exemple, lorsqu’une adaptation suggère que les résultats d’un essai prennent une certaine direction.
La méthodologie adaptative peut améliorer l’efficacité d’un essai, aussi bien pour le promoteur que pour les participants à l’essai. Toutefois, si elle n’est pas correctement conduite, il y a de grandes chances que l’essai génère des résultats cliniques difficiles à interpréter ou à traduire dans la pratique quotidienne.
Méthodologies adaptatives dans les maladies rares
Les essais cliniques conduits sur des maladies rares ne peuvent généralement recruter qu’un petit nombre de participants. La planification d’un essai clinique de petite taille, notamment lorsqu’il porte sur une maladie rare, peut poser plusieurs problèmes. La variabilité des essais de petite taille est plus importante que celle des essais de plus grande taille et de ce fait, les méthodologies standard peuvent faire que les essais ne soient adaptés qu’aux effets importants.
Les contraintes spécifiques aux essais sur les maladies rares rendent les méthodologies adaptatives particulièrement attrayantes. Les essais classiques sur les maladies rares ont généralement une puissance adaptée aux effets importants. La puissance d’un test statistique est sa capacité à détecter un effet, si cet effet existe réellement. En termes statistiques, c’est la probabilité de rejeter une hypothèse nulle fausse.
Dans certains cas, le rejet de l’hypothèse nulle n’est pas possible, non pas parce qu’elle est vraie, mais parce qu’on ne dispose pas de preuves suffisantes pour affirmer qu’elle est fausse. Ceci peut s’expliquer par le fait que la taille de l’étude expérimentale n’est pas suffisante pour rejeter l’hypothèse nulle. Ainsi, la puissance d’un test peut être décrite comme la probabilité de ne pas commettre une erreur de type II (c’est-à-dire le non-rejet de l’hypothèse nulle alors qu’elle est fausse).
Les méthodologies adaptatives constituent une alternative intéressante car :
- Elles raccourcissent le processus de développement sans compromettre la validité ou l’efficacité.
- Les traitements inefficaces peuvent être identifiés plus tôt.
- Elles permettent une utilisation plus efficace des ressources.
Cependant, il est important de savoir ce qu’une méthodologie adaptative peut ou ne peut pas faire en cas de maladies rares. Les méthodologies adaptatives ne peuvent en fait surtout pas rendre un médicament plus efficace. En revanche, elles peuvent identifier plus tôt les traitements inefficaces. Cette identification précoce permet de limiter les ressources allouées à l’étude d’un traitement inefficace et de les réaffecter à des traitements plus prometteurs.
Approches possibles en méthodologie adaptative
Le terme « adaptative » recouvre diverses méthodologies, mais la plupart d’entre elles ont une structure simple. Un essai adaptatif se compose d’étapes exploratoires et confirmatoires, selon une approche similaire à celle du processus de développement clinique global utilisé pour de multiples types d’essais (phase I, phase II et phase III). Des modifications peuvent donc être apportées aux hypothèses ou aux paramètres de la méthodologie.
Étapes exploratoires :
- Possibilité de modifier les principaux éléments de la méthodologie (supprimer des bras de traitement, par exemple)
- Incertitude statistique (par exemple, biais, variabilité, sélection incorrecte)
- Estimation des effets du traitement (bénéfiques ou indésirables)
Étapes confirmatoires :
- Le contrôle des erreurs statistiques et des biais opérationnels est primordial
- Un contrôle rigoureux des erreurs de type I (par exemple, considérer un traitement comme efficace alors qu’en réalité, il ne l’est pas) est nécessaire.
Les règles d’arrêt précoce pour futilité (lorsque le traitement ou l’essai ne produit pas de résultats utiles) ou efficacité constituent la méthodologie adaptative la plus couramment utilisée dans les essais.
Ces règles sont prédéterminées et vérifiées par une ou plusieurs analyses intermédiaires. Elles évitent que les participants ne prennent des médicaments qui n’auront pas d’effets bénéfiques ou dont la sécurité n’est pas garantie. Fait plus important, s’il s’avère que le médicament de l’essai est cliniquement plus efficace que le produit de contrôle, il ne serait pas éthique de continuer à administrer le médicament de contrôle moins efficace. Les règles d’arrêt précoce pour futilité permettent de stopper l’administration d’un médicament de contrôle moins efficace.
Dans certaines méthodologies, des bras de traitement sont supprimés au cours de l’essai ou une sous-population est sélectionnée en fonction d’un biomarqueur ayant un intérêt.
Certaines méthodologies permettent de réévaluer la taille de l’échantillon, par exemple, augmenter la population de patients si les résultats semblent prometteurs.
La randomisation adaptative est un autre exemple de méthodologie qui est intuitivement intéressante. En effet, elle permet de traiter une plus forte proportion de patients avec le traitement du « meilleur » bras (le cas échéant). Ces méthodologies adaptatives d’essais sont principalement basées sur des analyses intermédiaires non aveugles qui estiment les effets du traitement, ce qui signifie que les analystes savent quel traitement a été attribué aux participants.
Exemples de méthodologies adaptatives d’essais
Exemple 1 : méthodologie séquentielle par groupes
Une méthodologie séquentielle par groupes est un exemple type d’essai de phase III avec des règles d’arrêt précoce pour futilité ou efficacité. Dans l’exemple d’essai décrit dans le diagramme ci-dessous, les patients ont été randomisés pour recevoir le traitement de première intention composé d’un seul médicament, ou celui associant deux médicaments.
Deux étapes intermédiaires permettaient de décider de l’arrêt précoce de l’essai et de réaliser une analyse avant le recueil de tous résultats de l’essai. L’essai aurait pu être arrêté :
- Lors de la première analyse intermédiaire, pour futilité basée sur la survie sans progression (SSP) : le patient présente-t-il ou non une progression d’un cancer spécifique.
- Lors de la deuxième analyse intermédiaire, pour futilité ou efficacité basées sur la survie globale.
On oublie souvent que la méthodologie séquentielle par groupes est un exemple classique de méthodologie adaptative, car elle était déjà utilisée avant que les autres méthodologies adaptatives ne deviennent courantes. Les possibilités d’adaptation sont planifiées à l’avance dans la méthodologie de l’essai, ce qui permet d’ajuster relativement facilement la puissance et l’erreur de type I ou les tests séquentiels lorsque de multiples tests sont réalisés. Cela permet de maintenir la puissance et l’erreur de type I globales.
- Une méthodologie séquentielle par groupes permet des arrêts précoces sur la base de la survie sans progression ou de la survie globale. Dans cet exemple, les participants ont été affectés par randomisation à l’un des deux bras et ont reçu le traitement 1 ou une combinaison du traitement 1 et du traitement 2.
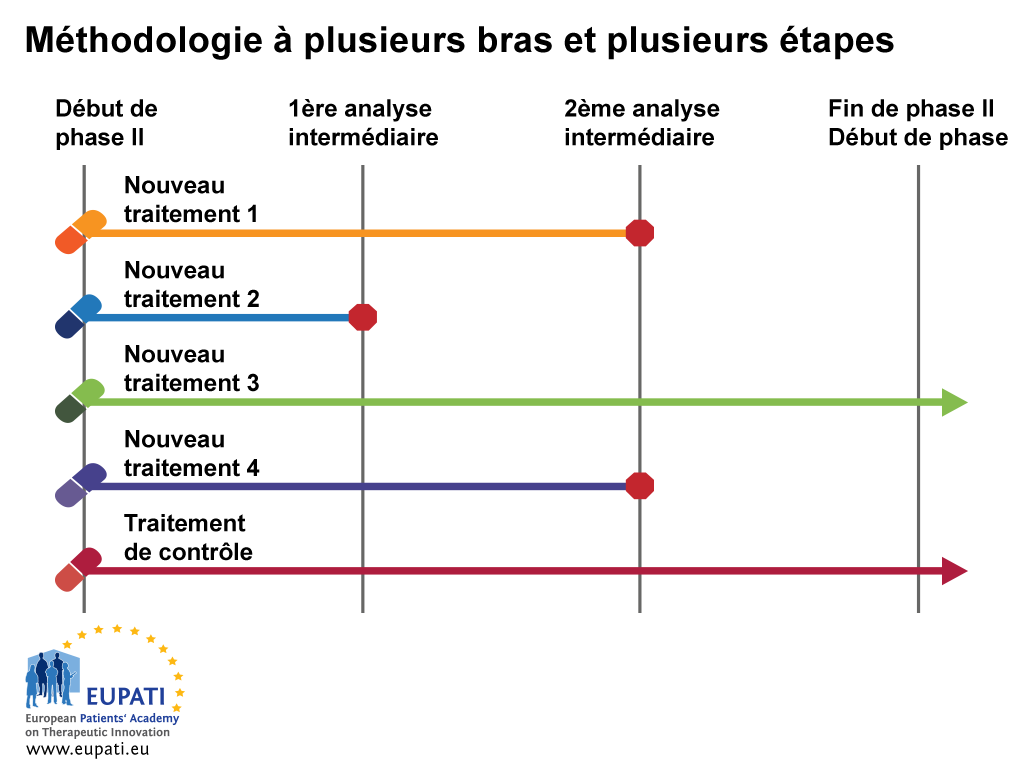
Exemple 2 : méthodologie à plusieurs bras et plusieurs étapes (MAMS)
L'essai à plusieurs bras et plusieurs étapes (MAMS) est un nouveau paradigme de conduite des essais contrôlés randomisés qui fait appel à une méthodologie adaptative intéressante.
Les essais MAMS permettent la comparaison simultanée d'un certain nombre de traitements expérimentaux à un seul traitement de contrôle. Ce type d'essai fournit plus rapidement des réponses et il est potentiellement moins coûteux qu'une série d'essais aux méthodologies traditionnelles.
Dans cet exemple, il s'agit d'une méthodologie qui utilise de multiples bras et étapes en même temps.
La méthodologie MAMS nécessite la mesure du critère d'évaluation principal intermédiaire et définitif. La mesure du critère d'évaluation définitive est celle sur lesquelles les conclusions finales doivent se baser ; tandis que la mesure du critère d'évaluation intermédiaire permet de mettre en évidence les preuves émergentes.
- La méthodologie à plusieurs bras et plusieurs étapes (MAMS) permet de tester simultanément de multiples traitements par rapport à un seul traitement de contrôle.
Lors de la première analyse intermédiaire de l'exemple ci-dessus, le nouveau traitement 2 est considéré comme n'apportant pas suffisamment de bénéfices par rapport au traitement de contrôle et il est abandonné à l'étape 2. Lors de la deuxième analyse intermédiaire, le recrutement dans les bras des nouveaux traitements 1 et 4 est arrêté et seuls le traitement de contrôle et le nouveau traitement 3 sont poursuivis jusqu'à la fin de l'essai ainsi que dans les études de phase III.
Avantages de la méthodologie MAMS :
- Moins de patients Dans cette méthodologie, plusieurs essais sont menés en même temps, ce qui permet de réduire le nombre de patients randomisés dans le bras de contrôle.
- Globalement, le temps requis pour la découverte d'un médicament est réduit. Les étapes intermédiaires de la méthodologie MAMS remplacent l'étape de phase II menée séparément. La décision concernant l'efficacité suffisante du médicament est intégrée à l'essai sous forme de phase pilote.
- Moins de demandes d'AMM et d'approbations requises Un travail de réglementation est nécessaire pour un seul essai et non pour de multiples essais.
- Flexible Les bras non intéressants peuvent être supprimés et de nouveaux bras peuvent être ajoutés.
- Coût réduit Cette méthodologie d'essai nécessite moins de patients, moins de demandes d'AMM et moins de temps global, ce qui permet de diminuer les coûts de développement.
Inconvénients de la méthodologie MAMS :
- Caractéristiques opérationnelles Du fait de la complexité de cette approche, elle peut être difficile à gérer et nécessite beaucoup de simulations lors de sa conception.
- Nombre de patients requis
Dépend des caractéristiques opérationnelles, mais si des bras de traitement sont ajoutés en cours d'essai, il peut être difficile de prévoir le budget et les contraintes réglementaires.
- Durée de l'essai
Si des bras de traitement sont ajoutés, il devient difficile de prévoir quand l'essai sera arrêté.
- Recrutement continuel (augmentation du nombre de patients) dans le bras de contrôle Pour éviter un biais d'immortalité lorsque de nouveaux bras de traitement sont ajoutés, le recrutement dans le bras de contrôle doit continuer pendant toute la durée de l'essai. Il faut également envisager ce qui se produira si une nouvelle norme de soins est disponible au cours de l'essai, le traitement de contrôle choisi sera-t-il toujours adapté ?
- Comparaison des bras expérimentaux La méthodologie MAMS permet uniquement des comparaisons entre chaque bras de traitement et le bras de contrôle, elle ne permet pas la comparaison entre les bras de traitement eux-mêmes.
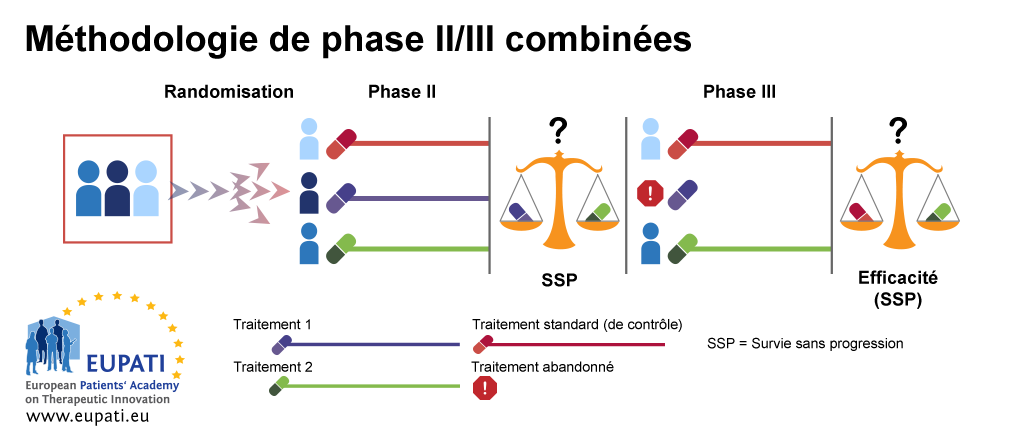
Exemple 3 : méthodologie de phase II/III combinées
La méthodologie de phase II/III combinée est souvent utilisée dans l'étude de maladies rares, on la nomme également « test de combinaison ». Dans l'exemple ci-dessous, dans la première étape de la méthodologie (phase IIb), les patients sont affectés par randomisation à l'un des trois bras de traitement. Le premier bras de traitement est le bras de contrôle, dans lequel les patients reçoivent le traitement standard. Les patients du deuxième et du troisième bras reçoivent des traitements différents, le traitement 1 ou le traitement 2.
À l'issue de la première étape (phase IIb), la survie sans progression (SSP) des bras de traitements 1 et 2 est comparée. Le bras de traitement le moins efficace est abandonné. L'autre bras de traitement est alors conservé dans la deuxième étape (phase III), au cours de laquelle l'efficacité du bras de traitement conservé est comparée à celle du bras de traitement standard.
- La méthodologie de phase II/III combinées permet de réaliser les phases II et III dans le cadre d’un seul essai.
Avantages de la méthodologie de phase II/III combinée
- Contribue à limiter le biais Les deux étapes sont conduites indépendamment et leurs résultats sont combinés à la fin en un seul résultat du test global.
- Réduit la durée et l'exposition des patients
Les phases II et III sont réalisées dans le cadre d'un seul essai.
- Relativement flexible La façon dont le bras de traitement est choisi pour la comparaison finale dans la phase II, qui est ensuite fusionnée avec la phase III, est relativement flexible.
- Utilisation efficace des ressources
Les données des patients des phases II et III contribuent toutes aux résultats finaux.
Inconvénients
- Analyses statistiques compliquées
Cette méthodologie requiert des aspects statistiques qui ne sont pas simples.
- Interruption du recrutement Le recrutement est interrompu entre les deux phases, lorsqu'il faut attendre que les données soient suffisantes pour être regroupées pour l'analyse intermédiaire qui décide de la poursuite ou de l'arrêt de l'essai.
- Freins d'ordre logistique Cette méthodologie impose des contraintes logistiques car elle nécessite de disposer d'un flux rapide de données afin que le nombre d'événements de l'analyse puisse être suivi régulièrement.
- Difficultés découlant des critères d'évaluation à long terme Cette méthodologie requiert de disposer relativement rapidement de données sur la SSP, ce qui s'avère plus difficile lorsque les critères d'évaluation sont à long terme.
- Risque de perte d'informations La combinaison des deux bras fait courir le risque de perdre des informations.
Implication des patients
Dans les méthodologies adaptatives, les patients peuvent contribuer à l'identification de la méthodologie la plus appropriée, en aidant à définir et à comprendre les besoins et les exigences de leur population. Les patients peuvent aussi être impliqués dans le Comité de surveillance et de suivi des données.
Conclusions
Les nouvelles méthodologies d'études peuvent permettre :
- Des stratégies de méthodologie flexibles ;
- Une utilisation plus efficace des ressources ;
- Un processus de développement plus court.
Du point de vue réglementaire, il est important de préserver la validité et l'intégrité des méthodologies adaptatives dans les études cliniques :
- Répondre à la même question que celle de la méthodologie classique des études ;
- Contrôler le biais opérationnel ;
- Contrôler les erreurs pouvant être statistiquement significatives ;
- Interprétation des résultats.
Annexes
- Principes des nouvelles méthodologies d'essais
Size: 818,293 bytes, Format: .pptx
Cette présentation évalue le paradigme traditionnel de développement clinique et discute des alternatives, notamment de la méthodologie adaptative pour les essais cliniques.
A2-4.08-v1.2