Last update: 23 Novembre 2015
Introduzione
Nel paradigma tradizionale dei disegni di studi clinici, ciascun nuovo trattamento deve passare attraverso un rigoroso processo di sviluppo. Dopo che gli studi di Fase I hanno avuto successo, è necessario uno studio di Fase II che mostri un’efficacia e una sicurezza sufficienti. Una volta che questi fattori sono stati dimostrati, il farmaco passa agli studi di Fase III, dove è confrontata con un trattamento standard (controllo). Questo processo, svolto separatamente per ciascun trattamento, richiede lunghe tempistiche, un gran numero di pazienti e risorse finanziarie ingenti. In più, nell’approccio tradizionale, nel corso dello studio non sono permesse modifiche.
Un nuovo approccio al disegno di studi clinici è rappresentato dal disegno adattivo. Gli studi clinici adattivi prevedono un’opportunità pre-pianificata di modifica di uno o più aspetti specifici dello studio. Questa procedura si basa di solito sull’analisi ad interim da parte dei partecipanti durante lo studio.
Esistono vari motivi per l’utilizzo di disegni adattivi (o percorsi adattivi) negli studi clinici. In un ambiente soggetto a problematiche economiche, i disegni adattivi sembrano essere attraenti per l’industria farmaceutica, istituzioni accademiche, medici clinici e pazienti.
Disegni adattivi
I disegni adattivi negli studi clinici sono disegni relativamente flessibili che consentono modifiche nel corso dello studio al fine di velocizzare e ottimizzare il processo. In punti temporali pre-pianificati nel contesto dello studio, possono essere svolte delle analisi relative ai dati cumulati dello studio, completamente in cieco o in aperto, e con o senza test statistici d’ipotesi formali. È importante che il processo venga modificato soltanto in modo da non incidere sulla validità e l’integrità dello studio.
I disegni adattivi possono porre difficoltà operative a causa della loro complessità e il processo di adattamento allo studio può introdurre distorsioni. Tale distorsione può essere statistica o operativa, ad esempio, se un adattamento suggerisce che i risultati di uno studio puntino in una certa direzione.
Il disegno adattivo può migliorare l’efficacia dello studio, a favore dello sponsor e dei partecipanti allo studio. Tuttavia, se non viene condotto in modo corretto, è molto probabile che tale studio generi risultati clinici difficili da interpretare o da tradurre nella pratica quotidiana.
Disegni adattivi in malattie rare
Gli studi clinici per malattie rare di solito sono per necessità di piccole dimensioni. La pianificazione di un piccolo studio clinico per una malattia rara può presentare diverse difficoltà. Gli studi di piccole dimensioni risultano avere una maggiore variabilità rispetto agli studi più ampi e ciò implica che i disegni standard possano portare a studi idonei solo per gli effetti più grandi.
I requisiti specifici degli studi per malattie rare rendono i disegni adattivi particolarmente attraenti. Gli studi classici per malattie rare sono comunemente potenziati relativamente ai grandi effetti. La potenza di un test statistico è la capacità di un test di identificare un effetto, se tale effetto esiste. In termini statistici, indica la probabilità che porti correttamente al rifiuto di un’ipotesi nulla.
In alcuni casi, potrebbe non essere possibile rifiutare l’ipotesi nulla, non tanto perché sia vera, ma piuttosto perché non abbiamo prove sufficienti per confutarla. Ciò potrebbe essere dovuto al fatto che l’esperimento non ha dimensioni tali da portare a rifiutare l’ipotesi nulla. In questo senso, la potenza di un test può essere descritta come la probabilità di non commettere un errore di tipo II (non rifiutando l’ipotesi nulla quando di fatto è falsa).
I disegni adattivi forniscono un’alternativa attraente poiché:
- abbreviano il processo di sviluppo senza comprometterne la validità e l’efficacia;
- sono in grado di individuare in anticipo i trattamenti inefficaci;
- consentono un uso più efficiente delle risorse.
Tuttavia, è importante riconoscere le possibilità di un disegno adattivo nel caso di malattie rare. La cosa più importante è che i disegni adattivi non possono rendere più efficace un farmaco. Possono, comunque, identificare i trattamenti inefficaci più rapidamente. Tale identificazione anticipata è in grado di minimizzare le risorse assegnate allo studio di un trattamento inefficace e consentiranno la distribuzione di ricorse a trattamenti più promettenti.
Possibili approcci nel disegno adattivo
Il termine “adattivo” copre un vario insieme di disegni, ma la maggior parte di essi prevede una struttura semplice. Nell’ambito di uno studio adattivo, si hanno fasi di apprendimento e di conferma, le quali seguono un approccio simile al processo globale di sviluppo clinico in ambienti multipli di studio (Fase I, Fase II e Fase III). Come risultato, potrebbero essere effettuate delle modifiche alle ipotesi o ai parametri di disegno.
Stadi di apprendimento:
- Possibilità di modificare gli elementi più importanti del disegno (ad esempio eliminare dei bracci di trattamento)
- Incertezza statistica (ad esempio distorsioni, variabilità, selezione errata)
- Stima degli effetti del trattamento (benefici o avversi).
Stadi di conferma:
- Controllo degli errori statistici e le distorsioni operative sono di estrema importanza.
- Necessità di un controllo rigoroso degli errori di Tipo I (ad esempio, scoprire che un trattamento risulta efficace quando di fatto non lo è).
Il disegno adattivo utilizzato più spesso prevede studi con regole d’interruzione anticipata per futilità (nel caso in cui il trattamento o lo studio non produca nessun risultato utile) o efficacia.
Tali regole sono prefissate e vengono verificate da una o più analisi ad interim. Prevengono l’assunzione di farmaci che non hanno un effetto benefico o non sono sicuri, da parte dei pazienti. Quel che più conta, nel caso si scopra che il farmaco dello studio sia più efficace del controllo, sarebbe non etico continuare con la somministrazione di un farmaco di controllo meno efficace. Delle regole d’interruzione anticipata consentono un arresto nella somministrazione di un farmaco di controllo meno efficace.
Esistono anche disegni in cui i bracci di trattamento vengono abbandonati nel corso di uno studio o una sottopopolazione viene selezionata sulla base di un biomarcatore d’interesse.
Alcuni disegni permettono una rivalutazione della dimensione del campione, ad esempio un aumento della popolazione dei pazienti se i risultati sembrano promettenti.
Una randomizzazione adattiva è un altro esempio di disegno intuitivamente attraente. In un disegno di questo tipo, il braccio “migliore” (se ne esiste uno) prevedrebbe il trattamento di una più ampia proporzione di pazienti. Tali disegni adattivi sono per lo più basati su analisi ad interim in aperto che stimano gli effetti del trattamento, cioè in cui gli analisti conoscono a quale trattamento sono stati assegnati i partecipanti.
Esempi di disegni di studio adattivi
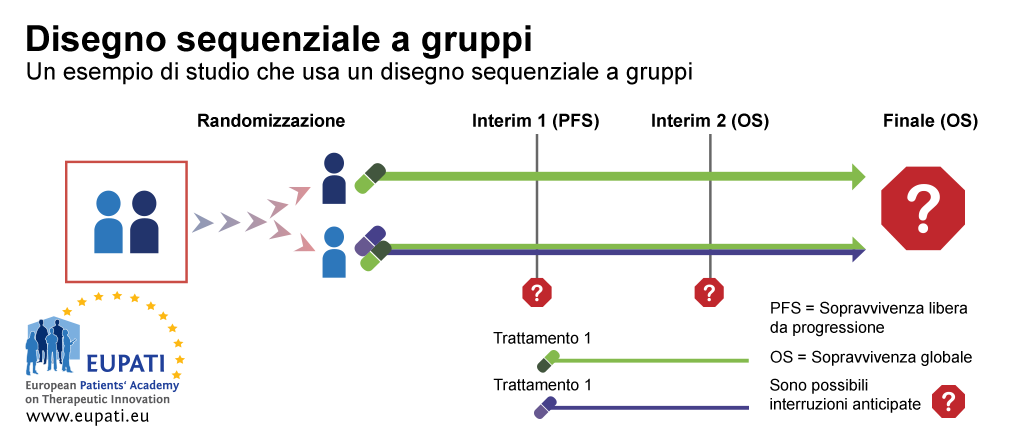
Esempio 1: disegno sequenziale a gruppi
Un disegno sequenziale a gruppi è un tipico esempio di disegno di Fase III con regole relative all’interruzione anticipata per futilità o efficacia. Nello studio esemplificativo illustrato nel diagramma sottostante, i pazienti sono stati randomizzati tra il trattamento di prima linea con un farmaco da solo o due farmaci in combinazione.
Si sono avuti due stadi provvisori in cui è stato possibile interrompere lo studio in anticipo ed effettuare un’analisi, prima che tutti i risultati dello studio venissero raccolti. Lo studio poteva essere interrotto:
- allo stadio Interim 1, per futilità, sulla base della sopravvivenza libera da progressione (progression-free survival, PFS), se il paziente era esente o meno da eventuale progressione di un determinato tipo di cancro;
- allo stadio Interim 2, per futilità o efficacia, sulla base della sopravvivenza globale.
Un disegno sequenziale a gruppi è un classico esempio spesso dimenticato quando si pensa a un disegno adattivo, poiché era già in uso prima che altri disegni adattivi diventassero di uso ordinario. Le opportunità di adattamento vengono pianificate in anticipo nel disegno dello studio e, durante la conduzione di sperimentazioni multiple, ciò rende relativamente più semplice correggere la potenza e l’errore di tipo I o gli studi sequenziali. Questa procedura conserva la potenza e l’errore di tipo I globali.
- Un disegno sequenziale a gruppi consente interruzioni anticipate sulla base della sopravvivenza libera da progressione o sulla sopravvivenza globale. In questo esempio, i partecipanti vengono suddivisi in modo casuale in uno di due gruppi e ricevono il Trattamento 1 oppure una combinazione di Trattamento 1 e Trattamento 2.
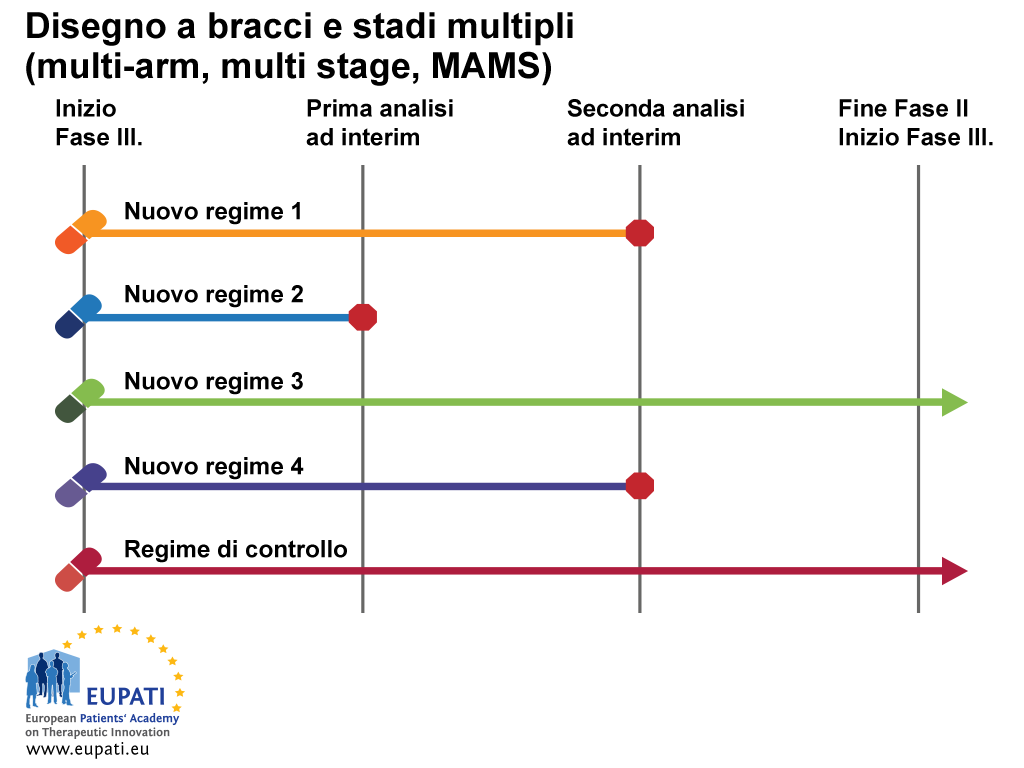
Esempio 2: disegno a bracci multipli e stadi multipli (multi-arm, multi stage, MAMS).
Lo studio a bracci multipli e stadi multipli (MAMS) è un nuovo paradigma per la conduzione di studi randomizzati controllati che fa uso di un interessante disegno adattivo.
Gli studi MAMS consentono la valutazione simultanea di una serie di trattamenti di studio contro un singolo braccio di controllo. Gli studi di questo tipo forniscono risposte anticipate e hanno potenzialmente un miglior rapporto costo-efficacia rispetto alle serie di studi progettati in modo tradizionale.
In questo esempio, è osservabile un disegno che utilizza bracci e stadi multipli contemporaneamente.
Il disegno MAMS richiede la misura di un esito primario finale e uno intermedio. Le conclusioni finali devono basarsi sulla misura dell'esito finale; la misura di esito intermedio fornisce un metodo di screening per far emergere le evidenze delle prove.
- Il disegno a bracci multipli e stadi multipli (multi-arm multi-stage, MAMS) consente che vengano studiati trattamenti multipli simultaneamente contro un singolo controllo.
Alla prima analisi ad interim nell'esempio sopra, si ritiene che il Nuovo regime 2 non abbia sufficienti benefici a confronto con il controllo e non viene fatto avanzare allo stadio 2. Alla seconda analisi ad interim, il reclutamento al Nuovo regime 1 e 4 viene interrotto e solo il trattamento di controllo e il Nuovo regime 3 vengono proseguiti fino al termine dello studio e fatti avanzare a studi di Fase III.
Vantaggi del disegno MAMS:
- Un numero inferiore di pazienti In questo disegno, vengono svolti diversi studi insieme, cosa che aiuta a ridurre il numero di pazienti randomizzati al braccio di controllo,
- Una durata globale inferiore richiesta per la scoperta del farmaco Gli stadi intermedi del disegno MAMS sostituiscono lo stadio separato relativo alla Fase II. La decisione riguardante la possibilità che il farmaco sia sufficientemente attivo è integrata come fase pilota in questo studio.
- Un numero inferiore di applicazioni e autorizzazioni necessarie Il lavoro di regolamentazione viene condotto per un solo studio invece che per studi multipli.
- Flessibilità I bracci che non risultano interessanti possono essere abbandonati e possono esserne aggiunti di nuovi.
- Costi ridotti Questo disegno di studio richiede un minor numero di pazienti e applicazioni normative e una durata globale inferiore: tutti questi elementi consentono di risparmiare in costi di sviluppo.
Svantaggi del disegno MAMS:
- Caratteristiche operative A causa della complessità di tale approccio, può essere difficile da gestire e richiede molte simulazioni durante il processo di disegno.
- Numero di pazienti necessario
Ciò dipende dalle caratteristiche operative, ma se vengono aggiunti bracci di trattamento nel corso dello studio, potrebbe essere difficile predire il budget e i problemi normativi.
- Durata dello studio
Se vengono aggiunti bracci di trattamento, diventa difficile predire quando lo studio sarà interrotto.
- Costante inclusione (reclutamento) al braccio di controllo Al fine di evitare una distorsione temporale una volta aggiunto un nuovo braccio di trattamento, il reclutamento del braccio di controllo deve proseguire per tutto il corso dello studio. È necessario, inoltre, considerare che cosa accade se diventa disponibile un nuovo standard di cura durante lo studio: il controllo è ancora importante?
- Confronto tra bracci sperimentali Il disegno MAMS permette solo confronti tra bracci individuali di trattamento e braccio di controllo; non consente un confronto tra bracci individuali di trattamento.
Esempio 3: disegno senza soluzione di continuità di Fase II/Fase III
Disegno senza soluzione di continuità di Fase II/Fase III viene utilizzato spesso nel caso di malattie rare: viene anche chiamato uno "studio di combinazione". Nell'esempio sotto, i pazienti vengono randomizzati tra tre bracci di trattamenti nel primo stadio del disegno (Fase IIb). Il primo braccio di trattamento è il braccio di controllo, in cui i pazienti ricevono la terapia dello standard di cura. I pazienti nel secondo e nel terzo braccio di trattamento ricevono trattamenti differenti, Trattamento 1 e Trattamento 2.
Al termine del primo stadio (Fase IIb), il Trattamento 1 e il Trattamento 2 vengono confrontati sulla base della migliore sopravvivenza libera da progressione (PFS). Il braccio di trattamento meno efficace viene eliminato. L'altro braccio di trattamento viene quindi proseguito al secondo stadio (Fase III). A questo stadio, viene effettuato un confronto dell'efficacia rispetto al trattamento dello standard di cura.
- Il disegno senza soluzione di continuità di Fase II e di Fase III deve essere eseguito nel contesto di un singolo studio.
Svantaggi del disegno senza soluzioni di continuità di Fase II/Fase III
- Aiuta a mitigare la distorsione Entrambe le fasi vengono condotte in modo indipendente e i risultati di entrambe le fasi vengono combinati al termine in un risultato di studio globale.
- Abbrevia i tempi e l'esposizione dei pazienti
La Fase II e la Fase III vengono svolte nel contesto di un singolo studio.
- Relativamente flessibile Il modo in cui viene scelto il braccio di trattamento per il confronto finale nella Fase II e in cui viene unito alla Fase III è relativamente flessibile.
- Uso efficiente delle risorse
I pazienti della Fase II e della Fase III contribuiscono entrambi a fornire dati per i risultati finali.
Svantaggi
- Analisi statistiche complicate
Questo disegno richiede aspetti statistici che non sono molto semplici.
- Intervalli nel reclutamento Tra le due fasi vi è un intervallo nel reclutamento, nell'attesa che siano raccolti dati sufficienti al fine di effettuare l'analisi ad interim che decide se proseguire o meno.
- Sfide logistiche Questo tipo di disegno è difficoltoso dal punto di vista logistico: richiede un rapido flusso di informazioni allo scopo di monitorare la serie di eventi.
- Difficoltà derivanti da endpoint a lungo termine Questo disegno richiede che le informazioni sulla PFS siano disponibili in modo relativamente rapido. Ciò diventa più difficile quando gli endpoint sono a lungo termine.
- Rischio di perdita d'informazioni La combinazione di due bracci comporta il rischio di perdita d'informazioni.
Coinvolgimento del paziente
L'opinione dei pazienti nel disegno adattivo può aiutare i ricercatori a identificare il disegno appropriato, contribuendo a definire e comprendere le necessità e i requisiti della popolazione di pazienti. Questi ultimi inoltre, possono essere coinvolti nel comitato di monitoraggio dei dati.
Conclusioni
Nuovi tipi di disegno di studio consentono:
- strategie flessibili di disegno
- un uso più efficiente delle risorse
- un processo di sviluppo dei farmaci più breve.
Dal punto di vista normativo, è importante sostenere la validità e l'integrità dei disegni adattivi negli studi clinici:
- rivolgere le stesse domande del disegno di studio classico;
- controllare le distorsioni operative;
- controllare gli errori potenzialmente significativi dal punto di vista statistico;
- interpretare i risultati.
Allegati
- Principi dei nuovi disegni di studio
Size: 794,378 bytes, Format: .pptx
Questa presentazione esamina il paradigma tradizionale relativo allo sviluppo clinico e discute le alternative, in particolare il disegno adattivo per studi clinici.
A2-4.08-v1.2