Last update: 23 November 2015
Einleitung
Im traditionellen Paradigma des klinischen Prüfungendesigns muss jede neue Behandlung einen strengen Entwicklungsprozess durchlaufen. Nach erfolgreichen Phase I-Studien ist eine Phase II-Studie erforderlich, um eine ausreichende Wirksamkeit und Sicherheit nachzuweisen. Wurde dieser Nachweis erbracht, wird das Arzneimittel in Phase III-Studien mit einer Standardbehandlung (Kontrolle) verglichen. Dies für jede Behandlung separat durchzuführen erfordert eine lange Zeit, eine große Anzahl von Patienten und erhebliche finanzielle Mittel. Darüber hinaus sind beim traditionellen Ansatz während des Studienverlaufs keine Modifikationen erlaubt.
Ein neuer Ansatz im klinischen Prüfungendesign ist das adaptive Design bei klinischen Prüfungen. Adaptive klinische Prüfungen beinhalten eine vorgeplante Möglichkeit für die Modifikation von einem oder mehreren bestimmten Aspekten der Studie. Dies erfolgt in der Regel auf Grundlage der Analyse von Zwischendaten von Teilnehmern während der Studie.
Es gibt viele Gründe, adaptive Designs (oder adaptive Wege) in klinischen Prüfungen zu verwenden. In einer Umgebung mit wirtschaftlichen Herausforderungen erscheinen adaptive Designs als attraktiv für die pharmazeutische Industrie, akademische Einrichtungen, Ärzte und Patienten.
Adaptive Designs
Adaptive Designs sind relativ flexible klinische Prüfungendesigns, die während des Verlaufs der Studie Modifikationen ermöglichen, um das Verfahren zu rationalisieren und zu optimieren. Die Analysen der anfallenden Studiendaten werden zu vorgeplanten Zeitpunkten innerhalb der Studie durchgeführt, auf eine voll verblindete oder unverblindete Weise, und können mit oder ohne formelle statistische Hypothesentestung stattfinden. Es ist wichtig, dass das Verfahren nur in einer Weise modifiziert wird, die die Gültigkeit und Integrität des Verfahrens nicht beeinträchtigt.
Adaptive Designs können aufgrund ihrer Komplexität operative Herausforderungen darstellen, und die Anpassung der Studie kann zu Verzerrungen führen. Diese Verzerrung kann statistisch oder operativ sein – zum Beispiel, wenn eine Anpassung vermuten lässt, dass die Ergebnisse einer Studie in eine bestimmte Richtung weisen.
Adaptives Design kann die Wirksamkeit der Studie verbessern, sowohl für den Sponsor, als auch für die Studienteilnehmer. Wird die Studie jedoch nicht richtig durchgeführt besteht ein hohes Risiko, dass sie klinische Ergebnisse erzeugt, die schwierig zu interpretieren oder in die tägliche Praxis umzusetzen sind.
Adaptive Designs in seltenen Krankheiten
Klinische Prüfungen für seltene Krankheiten sind, notgedrungenerweise, eher kleine Studien. Die Planung einer kleinen klinischen Studie, insbesondere für eine seltene Erkrankung, kann zahlreiche Herausforderungen darstellen. Kleine Studien weisen mehr Variabilität auf als größere Studien, was impliziert, dass Standard-Designs zu Studien führen, die nur für große Wirkungen angemessen sind.
Die besonderen Anforderungen der Studien für seltene Krankheiten machen adaptive Designs besonders ansprechend. Klassische Studien für seltene Krankheiten werden in der Regel für große Wirkungen durchgeführt. Die Stärke eines statistischen Tests ist die Fähigkeit des Tests, eine Wirkung nachzuweisen, wenn die Wirkung tatsächlich besteht. In der Statistik-Fachsprache ist es die Wahrscheinlichkeit, dass eine Nullhypothese zutreffenderweise zurückgewiesen wird.
In einigen Fällen sind wir eventuell nicht in der Lage, die Nullhypothese zurückzuweisen, nicht weil sie nicht wahr ist, sondern weil wir keine hinreichende Evidenz dagegen haben. Der Grund kann sein, dass das Experiment nicht groß genug ist, um die Nullhypothese zurückzuweisen. In diesem Sinne kann die Teststärke als die Wahrscheinlichkeit beschrieben werden, dass es zu keinem Fehler 2. Art kommt (dass die Nullhypothese nicht zurückgewiesen wird, wenn sie eigentlich falsch ist).
Adaptive Designs bieten eine ansprechende Alternative, zumal:
- sie den Entwicklungsprozess verkürzen, ohne dabei die Gültigkeit oder Wirksamkeit zu beeinträchtigen
- unwirksame Behandlungen früher identifiziert werden können
- sie eine effizientere Verwendung von Ressourcen ermöglichen.
Allerdings ist es wichtig, zu erkennen, was ein adaptives Design in der Lage ist, im Falle von seltenen Krankheiten zu bewirken, und was nicht. Am wichtigsten ist, dass adaptive Designs ein Arzneimittel nicht wirksamer machen können. Jedoch können mit ihrer Hilfe unwirksame Behandlungen früher identifiziert werden. Eine solche Früherkennung kann die für die Untersuchung einer unwirksamen Behandlung bereitgestellten Ressourcen minimieren und die Umverteilung von Ressourcen auf vielversprechendere Behandlungen ermöglichen.
Mögliche Ansätze im adaptiven Design
Der Begriff ‘adaptiv’ steht für eine Reihe von Designs, wobei die meisten von ihnen einer einfachen Struktur folgen. In einer adaptiven Studie gibt es Lern- und Bestätigungsstufen, die beim gesamten klinischen Entwicklungsprozess über mehrere Studienphasen (Phase I, Phase II und Phase III) einem ähnlichen Ansatz folgen. Folglich können Änderungen an Hypothesen oder den Designparametern vorgenommen werden.
Lernstufen:
- Die wichtigsten Design-Elemente können verändert werden (z.B. Weglassen von Behandlungsarmen)
- Statistische Unsicherheit (z.B. Verzerrung, Variabilität, falsche Auswahl)
- Einschätzung der Behandlungseffekte (vorteilhaft oder nachteilig)
Bestätigungsstufen:
- Die Kontrolle der statistischen Fehler und der operativen Verzerrungen sind von größter Bedeutung
- Eine strenge Kontrolle von Typ-I-Fehlern ist erforderlich (wenn beispielsweise eine Behandlung für effizient erachtet wird, obwohl sie es in der Tat nicht ist).
Das am häufigsten verwendete adaptive Design sind Studien, bei denen in Bezug auf Nutzlosigkeit oder Wirksamkeit frühe Abbruchregeln gelten (wenn die Behandlung oder die Studie keine nützlichen Ergebnisse liefert).
Diese Regeln sind vorbestimmt und werden durch eine oder mehrere Zwischenanalysen verifiziert. Sie verhindern, dass die Teilnehmer Arzneimittel einnehmen, die keine positive Wirkung haben oder unsicher sind. Am wichtigsten ist: wenn festgestellt wird, dass das Prüfpräparat klinisch wirksamer ist, als die Kontrolle, wäre es unethisch, weiterhin das weniger wirksame Kontrollarzneimittel zu verabreichen. Frühe Abbruchregeln im Falle von Nutzlosigkeit ermöglichen eine Pause in der Verabreichung des weniger wirksamen Kontrollarzneimittels.
Es gibt auch Designs, bei denen die Behandlungsarme im Verlauf der Studie weggelassen werden, oder bei denen eine Unterpopulation auf der Grundlage eines entsprechenden Biomarkers ausgewählt wird.
Einige Designs erlauben die Neuschätzung der Stichprobengröße, zum Beispiel, eine Erhöhung der Patientenpopulation, wenn die Ergebnisse vielversprechend erscheinen.
Adaptive Randomisierung ist ein weiteres Beispiel für ein intuitiv ansprechendes Design. Bei diesem Design wird ein höherer Anteil Patienten mit dem „besseren” Arm behandelt (wenn es einen gibt). Diese adaptiven Studiendesigns basieren meist auf unverblindeten Zwischenanalysen, die eine Einschätzung der Behandlungseffekte ermöglichen. Das bedeutet, dass es den Analysten bekannt ist, welcher Teilnehmer zu welcher Behandlung zugeteilt wurde.
Beispiele für adaptive Studiendesigns
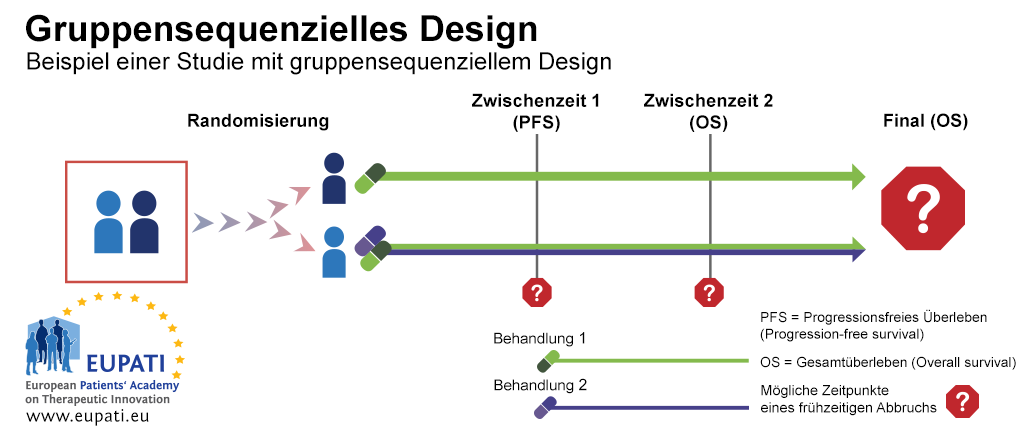
Beispiel 1: Gruppensequenzielles Design
Ein gruppensequenzielles Design ist ein typisches Beispiel einer Phase-III-Studie, die Regeln für den frühen Abbruch im Falle von Nutzlosigkeit oder Unwirksamkeit enthält. In der im nachstehenden Diagramm dargestellten Studie wurden die Patienten zwischen der Erstbehandlung mit entweder einem Arzneimittel alleine oder der Kombination aus zwei Arzneimitteln randomisiert.
Es gab zwei Zwischenstufen, wo es möglich war, die Studie vorzeitig zu beenden und Analysen durchzuführen, bevor alle Testergebnisse gesammelt wurden. Die Studie hätte an folgenden Punkten abgebrochen werden können:
- Bei Zwischenzeit 1, aus Gründen der Nutzlosigkeit basierend auf dem progressionsfreien Überleben (PFS) – ob der Patient von Fortschreiten einer bestimmten Krebsart frei bleibt, oder nicht
- Bei Zwischenzeit 2, aus Gründen der Nutzlosigkeit oder Unwirksamkeit, basierend auf dem Gesamtüberleben.
Gruppensequenzielles Design ist ein klassisches Beispiel, das oft vergessen wird, wenn man über adaptives Design nachdenkt, da es bereits im Einsatz war, bevor andere adaptive Designs weitere Verbreitung fanden. Anpassungsmöglichkeiten sind im Studiendesign im Voraus geplant, was zur Folge hat, dass bei der Durchführung mehrerer Auswertungen die Stärke und Fehler vom Typ I von sequenzielle Untersuchungen relativ einfach angepasst werden können. Dadurch bleiben Gesamtstärke und Fehler vom Typ I erhalten.
- Gruppensequenzielles Design ermöglicht einen frühen Abbruch auf Grund des progressionsfreien Überlebens oder Gesamtüberlebens. In diesem Beispiel wurden die Teilnehmer auf einen der beiden Studienarme randomisiert und erhielten entweder Behandlung 1, oder eine Kombination von Behandlung 1 und Behandlung 2.
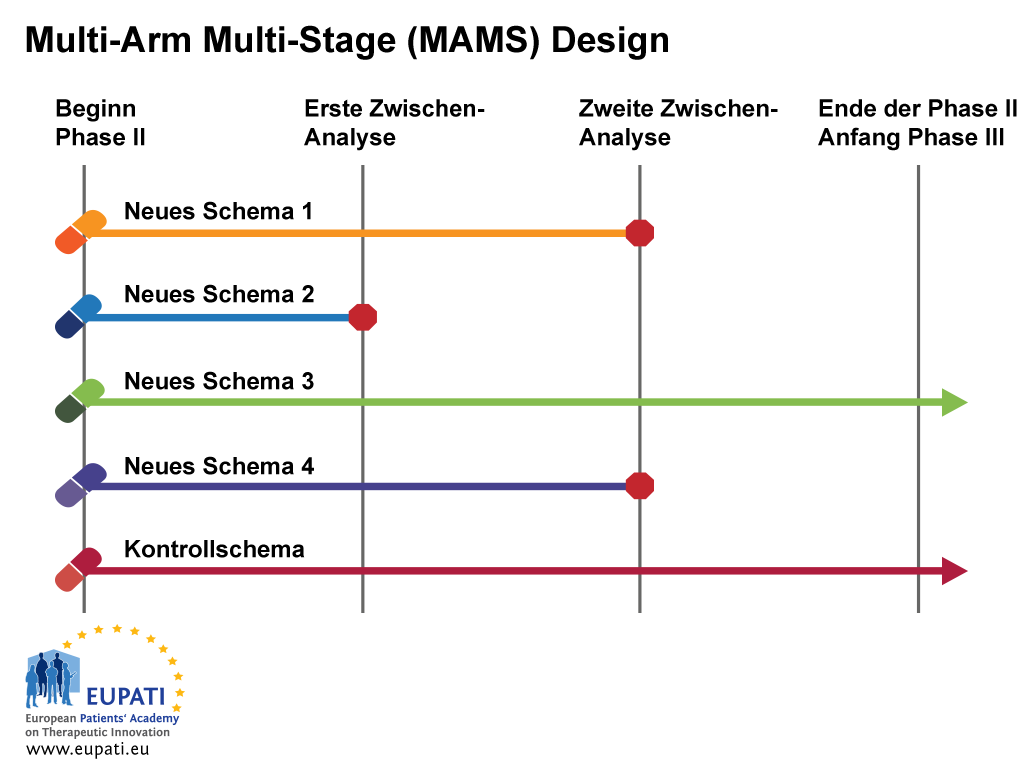
Beispiel 2: Multi-Arm Multi-Stage Design (MAMS)
Die Multi-Arm, Multi-Stage (MAMS) Studie ist ein neues Paradigma für die Durchführung von randomisierten kontrollierten Studien, die sich eines interessanten adaptives Designs bedient.
MAMS-Studien ermöglichen die gleichzeitige Bewertung mehrerer Forschungsbehandlungen gegenüber einer einzigen Kontrolle. MAMS-Studien liefern frühere Antworten und sind potenziell kostengünstiger als eine Reihe von traditionell gestaltete Studien.
In diesem Beispiel sehen wir ein Design, das mehrere Arme und Stufen zur gleichen Zeit verwendet.
Das MAMS-Design erfordert die Messung des endgültigen primären und des intermediären primären Endpunktes. Die Messung des endgültigen Endpunktes ist diejenige, auf der die endgültigen Schlussfolgerungen basieren sollten; die Messung des intermediären Endpunktes bietet ein Mittel zur Überprüfung auf das Vorliegen von Beweismitteln.
- Das Multi-Arm Multi-Stage Design (MAMS) ermöglicht die gleichzeitige Untersuchung mehrerer Behandlungen gegenüber einer einzigen Kontrolle.
Bei der ersten Zwischenanalyse im obigen Beispiel scheint Neues Schema 2 gegenüber der Kontrolle einen unzureichenden Nutzen zu haben und wird daher nicht zur Stufe 2 fortgesetzt. Bei der zweiten Zwischenanalyse wird die Aufnahme von Patienten zu den Neuen Schemata 1 und 4 eingestellt, und nur das Neue Schema 3 wird bis zum Ende der Studie fortgeführt und in Phase-III-Studien eingeschlossen.
Vorteile des MAMS-Designs:
- Weniger Patienten Bei diesem Design werden mehrere Studien gleichzeitig durchgeführt, was hilft, die Zahl der Patienten, die zum Kontrollarm randomisiert wurden, zu reduzieren.
- Insgesamt weniger Zeit erforderlich für die Arzneimittelentdeckung Die Zwischenschritte des MAMS-Designs ersetzen den separaten Phase-II-Schritt. Die Entscheidung, ob das Arzneimittel ausreichend aktiv ist, wird als Pilotphase in diese Studie aufgenommen.
- Weniger Anträge und Genehmigungen erforderlich Regulatorische Arbeit wird für eine Studie durchgeführt, anstelle für mehrere Studien.
- Flexibel Nicht relevante Arme können weggelassen und neue Arme hinzugefügt werden.
- Reduzierte Kosten Dieses Studiendesign erfordert weniger Patienten, weniger behördliche Anträge und insgesamt weniger Zeit, was alles dazu beiträgt, bei den Entwicklungskosten zu sparen.
Nachteile des MAMS-Designs:
- Merkmale Aufgrund der Komplexität dieses Ansatzes kann es schwierig sein, das Design zu verwalten, und es sind jede Menge Simulationen während des Designprozesses erforderlich.
- Erforderliche Anzahl an Patienten
Dies hängt von den Merkmalen ab, aber wenn Behandlungsarme im Verlauf der Studie hinzugefügt werden, kann es schwierig sein, Budget und Regulierungsfragen vorherzusagen.
- Studiendauer
Wenn Behandlungsarme hinzugefügt werden, wird es schwierig, vorherzusagen, wann die Studie beendet wird.
- Weiteres Anwachsen (Rekrutierung) des Kontrollarms Um eine zeitliche Verzerrung zu vermeiden, wenn neue Behandlungsarme aufgenommen werden, muss die Rekrutierung in der Kontrollgruppe während des gesamten Verlaufs der Studie fortgesetzt werden. Es müssen auch dahingehende Überlegungen angestellt werden, was passiert, wenn eine neue Standardbehandlung während der Studie verfügbar wird – ist die Kontrolle dann immer noch relevant?
- Vergleich zwischen den experimentellen Armen Das MAMS-Design ermöglicht nur Vergleiche zwischen den einzelnen Behandlungsarmen und der Kontrollgruppe; es ermöglicht keinen Vergleich zwischen den einzelnen Behandlungsarmen selbst.
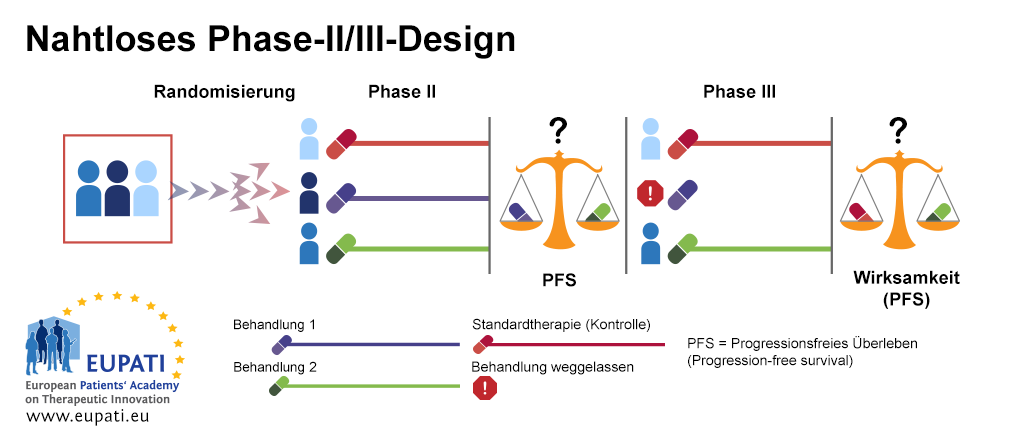
Beispiel 3: Nahtloses Phase-II- / Phase-III-Design
Nahtloses Phase II/Phase III-Design wird oft im Falle von seltenen Krankheiten verwendet; es wird auch ‘Kombinationstest’ genannt. Im untenstehenden Beispiel werden die Patienten zwischen drei Behandlungsarmen in der ersten Phase des Designs (Phase IIb) randomisiert. Der erste Behandlungsarm ist der Kontrollarm, in dem Patienten die Standardbehandlung erhalten. Im zweiten und dritten Arm erhalten die Patienten verschiedene Behandlungen – Behandlung 1 oder Behandlung 2.
Am Ende der ersten Stufe (Phase IIb), Behandlung 1 und Behandlung 2 werden auf Grundlage des besten progressionsfreien Überlebens (PFS) verglichen. Der weniger wirksame Behandlungsarm wird weggelassen. Der andere Behandlungsarm wird in der zweiten Stufe (Phase III) fortgesetzt. In dieser Stufe wird ein Wirksamkeitsvergleich gegenüber der Standardbehandlung durchgeführt.
- Das nahtlose Phase II/III-Design ermöglicht die Durchführung von Phase II und Phase III innerhalb einer Studie.
Vorteile des nahtlosen Phase-II- / Phase-III-Designs
- Hilft, Verzerrungen zu mildern Beide Schritte werden voneinander unabhängig durchgeführt, und die Ergebnisse beider Schritte werden am Ende in einem Gesamttestergebnis kombiniert.
- Verkürzt die Zeit und die Exposition der Patienten
Phase II und Phase III werden innerhalb einer Studie durchgeführt.
- Relativ flexibel Die Art und Weise, wie der Behandlungsarm für den abschließenden Vergleich in der Phase II gewählt und mit der Phase III zusammengeführt wird, ist relativ flexibel.
- Effiziente Verwendung von Ressourcen
Patienten aus Phase II und Phase III tragen beide Daten zu den endgültigen Ergebnissen bei.
Nachteile
- Komplizierte statistische Analysen
Dieses Design erfordert statistische Aspekte, die nicht so einfach sind.
- Lücken bei der Rekrutierung Es gibt eine Lücke in der Rekrutierung zwischen den beiden Phasen, während darauf gewartet wird, dass genügend Daten gesammelt werden, um die Zwischenanalyse durchführen zu können, die darüber entscheidet, ob die Studie fortgesetzt wird, oder nicht.
- Logistische Herausforderungen Dieses Design ist logistisch anspruchsvoll – es erfordert einen schnellen Datenfluss, sodass die Ereignisse in der Analyse weiterverfolgt werden können.
- Schwierigkeiten, die sich aus langfristigen Endpunkten ergeben Dieses Design erfordert, dass Informationen über PFS relativ schnell zur Verfügung stehen. Dies wird umso schwieriger, je langfristiger die Endpunkte bestimmt sind.
- Risiko von verlorenen Informationen Die Zusammenführung beider Arme birgt das Risiko von Informationsverlust
Patientenbeteiligung
Der Beitrag von Patienten zum adaptiven Design kann Forschern helfen, das geeignetste Design zu ermitteln, indem sie helfen, die Bedürfnisse und Anforderungen der Patientenpopulation zu definieren und zu verstehen. Patienten können auch in den Datenüberwachungsausschuss (Data Monitoring Committee) einbezogen werden.
Schlussfolgerungen
Neue Studiendesigns können Folgendes ermöglichen:
- Flexible Designstrategien
- Effizientere Verwendung von Ressourcen
- Kürzerer Entwicklungsprozess
Aus regulatorischer Sicht ist es wichtig, die Gültigkeit und Integrität der adaptiven Designs in klinischen Prüfungen zu erhalten:
- Behandlung der gleichen Frage wie beim klassischen Studiendesign
- Kontrolle der operativen Verzerrung
- Kontrolle der möglicherweise statistisch signifikanten Fehler
- Interpretation der Ergebnisse
Anlagen
- Prinzipien von neuen Studiendesigns
Size: 831,827 bytes, Format: .pptx
In dieser Präsentation wird das traditionelle Paradigma der klinischen Entwicklung evaluiert und Alternativen, insbesondere das adaptive Design für klinische Prüfungen, besprochen.
A2-4.08-v1.2