Last update: 19 Novembre 2015
Introduzione
Fin dall’inizio del processo di scoperta e sviluppo dei farmaci, i dati raccolti negli studi non clinici sono di fondamentale importanza per l’assunzione delle decisioni riguardanti l’efficacia e la sicurezza, ad esempio in materia di pianificazione del rischio, mitigazione del rischio, condizioni e specifiche dell’autorizzazione all’immissione in commercio, utilizzo del farmaco sul mercato e controllo della sicurezza post-commercializzazione (farmacovigilanza).
Le informazioni raccolte durante gli studi non clinici svolgono un ruolo chiave nelle decisioni riguardanti:
- gli studi clinici,
- la gestione e la mitigazione del rischio,
- l’autorizzazione all’immissione in commercio,
- la prescrizione di un farmaco a un paziente,
- gli studi di post-commercializzazione o di monitoraggio,
- e altro ancora.
Il quadro riportato di seguito illustra le esigenze e i fattori che sono determinanti nel processo di scoperta e sviluppo dei farmaci. Le informazioni non cliniche rivestono un ruolo fondamentale nella determinazione di tali esigenze e fattori. Questo articolo esplora il ruolo fondamentale degli studi non clinici come elemento di previsione importante per gli studi clinici sull’uomo.
Gli elementi chiave per la buona riuscita dello sviluppo dei farmaci: lo “Schema delle 5 R” (in cui “R” sta per “right”), ossia la regola delle 5 scelte corrette1
- Target corretto
- Forte correlazione tra il target del farmaco e la malattia
- Biomarcatori disponibili e predittivi
- Tessuto corretto
- Biodisponibilità ed esposizione del tessuto adeguate
- Definizione di biomarcatori farmacodinamici
- Chiara comprensione di farmacocinetica e farmacodinamica pre-clinica e clinica
- Comprensione delle interazioni con altri farmaci (interazioni farmaco-farmaco)
- Sicurezza corretta
- Margini di sicurezza chiari
- Comprensione dei rischi farmacologici secondari
- Comprensione dei metaboliti reattivi, della genotossicità e delle interazioni con altri farmaci
- Comprensione degli effetti collaterali pericolosi e di altri rischi
- Pazienti corretti
- Identificazione della popolazione di pazienti più recettiva
- Definizione del rapporto rischi-benefici per una data popolazione
- Potenziale commerciale corretto
- Costi-benefici rispetto a futuro standard di cura
- Attenzione posta sull’accesso al mercato
Dal laboratorio e dagli studi sugli animali ai pazienti
Un composto candidato non può essere somministrato all’uomo prima di aver raccolto un numero sufficiente di informazioni di supporto riguardo al suo profilo di sicurezza e agli effetti attesi. Gli studi non clinici forniscono queste informazioni di supporto mediante una serie di fattori pronostici importanti, quali la “prova del concetto”, il regime di dosaggio proposto, l’adeguato monitoraggio della sicurezza e un’idonea inclusione ed esclusione dei criteri.
Gli studi non-clinici sulle cellule (in vitro) e sugli animali (in vivo) dovrebbero quindi:
- dimostrare l’efficacia del composto candidato,
- fornire informazioni sul profilo di sicurezza del composto candidato, ad esempio studi intesi ad accertare la massima dose tollerata, nonché
- stimare gli effetti del composto candidato che non possono essere studiati sull’uomo, per esempio, l’effetto del composto sui feti o nelle donne gravide.
Estrapolazione dagli animali all’uomo
L’estrapolazione dalle informazioni raccolte attraverso gli studi in laboratorio e sugli animali all’applicazione di un farmaco sull’uomo richiede un giudizio professionale. Utili regole per i processi di estrapolazione sono state elaborate e descritte nelle linee guida del Comitato per i Medicinali per Uso Umano (CHMP, Committee for Human Medicinal Products)2 dell’Agenzia Europea del Farmaco (EMA, European Medicines Agency) e della Conferenza internazionale sull’armonizzazione (ICH, International Conference on Harmonisation)3 Queste linee guida specificano i tipi di studi che devono essere condotti prima di passare agli studi clinici.
La problematiche connesse al programma non clinico di un composto candidato possono essere causa di obiezioni durante la valutazione della domanda di autorizzazione all’immissione in commercio (Marketing Authorisation Application, MAA), in fase di revisione normativa. Questi casi suscitano domande riguardo alla rilevanza dei modelli non clinici utilizzati per l’indicazione proposta di destinare il composto candidato all’uso sull’uomo. Al fine di evitare queste problematiche, gli studi non clinici devono essere attentamente pianificati in modo che le aspettative generate dagli studi in laboratorio e sugli animali possano funzionare come strumenti di previsione soddisfacenti.
L’entità e l’ambito del programma non clinico che deve essere completato in maniera soddisfacente prima di iniziare gli studi clinici varia in base ai seguenti fattori:
- il tipo e la gravità della malattia in questione,
- le dimensioni e la dinamica della popolazione che il composto candidato è destinato a trattare,
- la fase dello studio clinico (Fase I, II e III, Fase IV di post-commercializzazione) e
- la dose prevista e durata del trattamento in esseri umani.
Tali considerazioni vengono utilizzate per giustificare i tipi di test o modelli animali utilizzati nel corso del programma non clinico.
Numerose aziende richiedono consulenza scientifica sugli studi non clinici alle autorità di regolamentazione come, ad esempio, l’Agenzia Europea del Farmaco (European Medicines Agency, EMA) o le autorità nazionali competenti. Questa consulenza scientifica aiuta l’azienda ad accertarsi che siano condotti i test e gli studi adeguati, in modo che in fase di MAA non sorgano importanti obiezioni riguardo alla pianificazione degli stessi. La richiesta e l’adesione ai consigli di questi organismi aumentano la probabilità di un risultato positivo in fase di MAA. La consulenza viene fornita alla luce delle conoscenze scientifiche più attuali e si basa sulla documentazione fornita dall’azienda.
I dati non clinici sono di fondamentale importanza nella prime fasi del processo di sviluppo di un composto candidato (vedere la Figura 1). Al momento in cui un farmaco diventa disponibile per essere prescritto (post-MAA), molti dei dati non clinici sulla sicurezza e l’efficacia verranno sostituiti dai dati tratti dagli studi clinici sull’uomo. Tuttavia, in alcuni casi, per esempio quando si tratta dell’effetto di un composto candidato sullo sviluppo del cancro o sulla riproduzione, le considerazioni di carattere etico impediscono di raccogliere dati da soggetti umani. In questi casi, l’utilizzo clinico di nuove medicine sarà diretto dai dati non clinici per un periodo più lungo. Alla fine, comunque, anche questi dovranno essere sostituiti da dati raccolti in questi casi, per esempio come parte della gestione del ciclo di vita e della farmacovigilanza successivi alla commercializzazione.
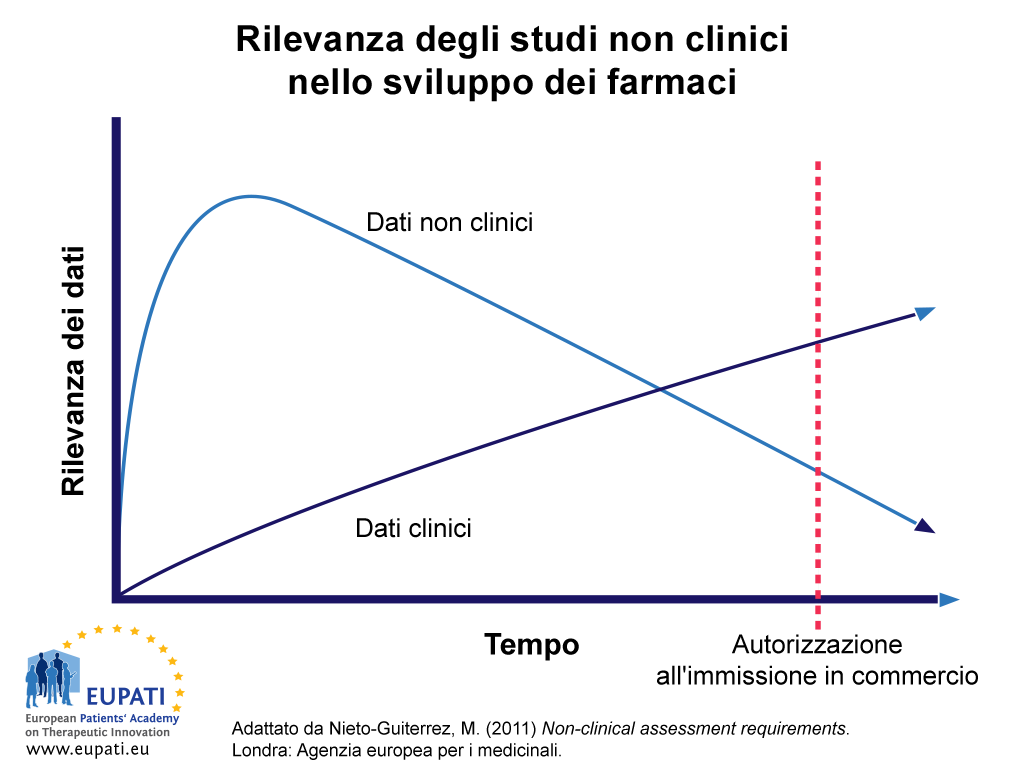
- Rilevanza degli studi non clinici nello sviluppo dei farmaci
La Figura 1 evidenzia l'importanza relativa e l'utilizzo dei dati non clinici nel processo di sviluppo dei farmaci nel corso del tempo. L'utilizzo dei dati ricavati da studi non clinici è maggiore rispetto a quello dei dati clinici fino a una fase avanzata del processo di sviluppo.
Idealmente, tutte le perplessità relative alla sicurezza della fase non clinica che si presentano durante il periodo di sviluppo dovrebbero essere risolte al momento in cui si presenta la domanda di autorizzazione all'immissione in commercio. Tuttavia, al momento della presentazione del dossier e della sua valutazione, possono essere ancora presenti importanti ragioni di perplessità relative alla sicurezza, riguardanti ad esempio la carcinogenicità, la genotossicità, le impurità genotossiche, la tossicità riproduttiva e l'epatotossicità.
Considerazioni etiche
L'accettabilità dell'utilizzo di animali come modelli di valutazione del rischio per l'uomo e per l'uso di tali modelli per simulare le patologie umane è illustrata nella Dichiarazione di Helsinki.4 La Dichiarazione di Helsinki fornisce la giustificazione etica e scientifica per la prima esposizione dei composti candidati a volontari sani. Inoltre, la Dichiarazione afferma che la ricerca biomedica dovrebbe basarsi su un'adeguata sperimentazione eseguita in laboratorio e sugli animali, oltre che su una profonda conoscenza della letteratura scientifica. Il benessere degli animali utilizzati per la ricerca deve essere rispettato.
Studi non clinici: Strumenti di previsione appropriati per gli studi sull'uomo?
Storicamente, le difficoltà legate al valore predittivo degli studi non clinici riguardavano la farmacocinetica, la farmacodinamica (efficacia) e gli aspetti connessi alla sicurezza nell'uomo che non possono essere facilmente previsti da studi non clinici. Molte nuove tecnologie in silico (modelli computerizzati), la farmacogenomica, i biomarcatori e i nuovi progetti esplorativi per gli studi clinici sono in rapida evoluzione e hanno tutti un'influenza positiva sul valore predittivo degli studi non clinici.
Ulteriori aggiuntive
- La Dichiarazione di Helsinki è disponibile in inglese, francese e spagnolo su Retrieved 13 July, 2021, from https://www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects/ (Estratto il 23 settembre 2015). è inoltre disponibile in tedesco, giapponese, portoghese, cecoslovacco e ungherese su http://www.wma.net/en/20activities/10ethics/10helsinki/ (Estratto il 23 settembre 2015)
Riferimenti bibliografici
- Adapted from Cook, D., Brown, D., Alexander, R., March, R., Morgan, P., Satterthwaite, G., & Pangalos, M. (2014). Lessons learned from the fate of AstraZeneca's drug pipeline: A five-dimensional framework. Nature Reviews Drug Discovery, 13, 419-431. doi:10.1038/nrd4309
- European Medicines Agency. (2015) Non-clinical guidelines. Retrieved 24 July, 2015, from http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_000083.jsp&mid=WC0b01ac0580027548
- International Conference on Harmonisation (2015). ICH Guidelines. Retrieved 24 July, 2015, from http://www.ich.org/products/guidelines.html
- World Medical Association. (2013) WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects. Retrieved 24 July, 2015, from http://www.wma.net/en/30publications/10policies/b3/
- Nieto-Guiterrez, M. (2011) Non-clinical Assessment Requirements. Brussels: European Medicines Agency. Retrieved 24 July, 2015, from http://www.ema.europa.eu/docs/en_GB/document_library/Presentation/2011/06/WC500107868.pdf
Allegati
- Presentazione: Sviluppo non clinico
Size: 394,828 bytes, Format: .pptx
Presentazione sullo sviluppo non clinico dei farmaci. Questa presentazione si occupa degli obiettivi di sviluppo non clinico, attività di background (inclusa la fabbricazione del principio attivo necessario), tipi di studio non clinico, specifiche sulla creazione di modelli animali, considerazioni sulle tempistiche e sulla durata e risultati non clinici che potrebbero interrompere lo sviluppo di un composto candidato.
A2-2.02.1-v1.3