Last update: 19 ноября 2015
Введение
С самых начальных этапов процесса поиска и разработки медицинских препаратов данные, получаемые в ходе доклинических исследований чрезвычайно важны для принятие решений, касающихся результативности и безопасности, например, относительно планирования управления рисками, профилактики рисков, условий и спецификаций регистрационного свидетельства, использования медицинского препарата на рынке и постмаркетингового мониторинга безопасности (фармакологического надзора).
Информация, полученная в процессе доклинических исследований, играет ключевую роль при принятии решений
- о клинических испытаниях,
- об управлении рисками и их профилактике,
- заявках на выдачу регистрационных свидетельств,
- о назначении медицинского препарата пациенту,
- о пост-маркетинговых или контрольных исследованиях
- и т. п.
В концепции, приведенной далее, демонстрируются потребности и факторы, которые являются основными в процессе поиска и разработки медицинских препаратов. Информация, полученная в процессе доклинических исследований, играет ключевую роль при принятии решений. В этой статье демонстрируется важная роль доклинических исследований как прототипа клинических исследований с участием пациентов.
Ключ к успешной разработке медицинских препаратов — концепция пяти «П»1
- Правильная мишень
- Сильная взаимосвязь между мишенью для медицинского препарата и заболеванием
- Доступные и прогнозирующие биомаркеры
- Правильная ткань
- Полноценная биодоступность и воздействие на ткани
- Определение фармакодинамических биомаркеров
- Четкое представление о доклинической и клинической фармакокинетике и фармакодинамике
- Представление и взаимодействии с другими медицинскими препаратами (взаимодействие «лекарство-лекарство»)
- Правильная безопасность
- Четкие границы безопасности
- Представление о вторичных фармакологических рисках
- Представление о реактивных метаболитах, генотоксичности и взаимодействии с другими медицинскими препаратами
- Представление об опасных побочных эффектах и других видах ответственности
- Правильные пациенты
- Определение самой чувствительной группы пациентов
- Определение соотношения преимуществ и рисков для данной группы
- Правильный коммерческий потенциал
- Издержки и доходы против будущих стандартов медицинской помощи
- Концентрация на доступе на рынок
От исследований в лаборатории и на животных к пациентам
Вещество-кандидат не может вводиться людям, пока не собрано достаточно подтверждающей информации относительно его характеристик безопасности и эффектов, которые этот препарат должен оказывать. Доклинические исследования позволяют получить эту необходимую информацию, предоставляя важные прогностические параметры, такие как «доказывание концепции», предполагаемый регламент дозирования, полноценный мониторинг безопасности и подходящие критерии для включения и исключения.
В этой связи доклинические исследования клеток (в лабораторных условиях) и исследования на животных (в реальных условиях) должны:
- демонстрировать результативность вещества-кандидата,
- обеспечивать информацию о характеристиках безопасности вещества-кандидата, например, при помощи исследований для изучения максимальной переносимой дозы, а также
- оценивать воздействие вещества-кандидата, которые невозможно изучить на людях, например, воздействие вещества на плод во время беременности или на саму беременную женщину.
Перенос с животных на людей
Перенос информации, собранной в ходе лабораторных исследований и исследованиях животных, на применение медицинского препарата людьми требует профессиональной оценки. Полезные правила для организации процесса сформулированы и изложены в руководстве Комитета по лекарственным средствам для медицинского применения (Committee for Human Medicinal Products, CHMP)2 Европейского агентства по лекарственным средствам (European Medicines Agency, EMA) и Международной конференции по гармонизации (International Conference on Harmonisation, ICH)3. В этих руководствах указываются те виды исследований, которые обязательно нужно провести до начала клинических испытаний.
Проблемы, связанные с программой доклинических испытаний вещества-кандидата, могут вызывать возражения во время рассмотрения заявки на получение регистрационного свидетельства надзорно-контрольными органами. Такие случаи вызывают вопросы относительно значимости доклинических моделей, которые используются для симптомов, для лечения которых предположительно предназначается вещество-кандидат. Во избежание указанных проблем необходимо тщательное планирование доклинических исследований таким образом, чтобы ожидания, сформированные в ходе лабораторных исследований и исследований на животных, могли функционировать как удовлетворительные прогнозные параметры.
Степень и масштабы программы доклинических исследований, которые должны успешно завершиться до начала клинических испытаний, различаются в зависимости от следующих факторов:
- вид и степень тяжести заболевания-мишени,
- размер группы и динамика вещества-кандидата, которое предназначено для лечения,
- фаза клинических испытаний (1,2,3 фаза и пост-маркетинговая 4 фаза), а также
- предполагаемая доза и продолжительность курса лечения для людей.
Указанные соображения используются с целью обосновать использование именно этих испытаний или животных во время доклинических исследований.
Многие страны будут рады получить рекомендации научного характера относительно доклинических исследований со стороны контрольно-надзорных органов, Европейского агентства по лекарственным средствам или национальных компетентных органов. Научные рекомендации помогают компании обеспечить проведение соответствующих тестов и исследований, так что на момент получения регистрационного свидетельства значительных возражений относительно дизайна испытаний не ожидается. Поиск и получение консультаций от указанных учреждений повышает вероятность положительного решения по заявке на выдачу регистрационного свидетельства. Рекомендации предоставляются в свете текущих научных знаний и основаны на документах, предоставленных компанией.
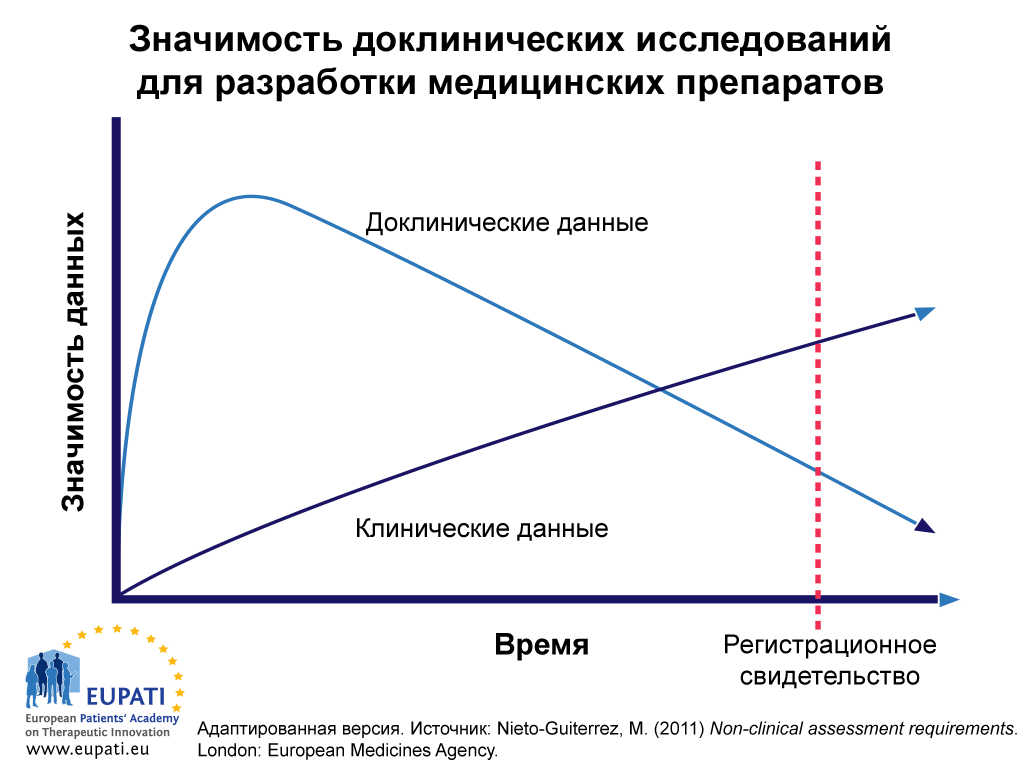
Доклинические данные имеют самое большое значение на начальных процессах разработки вещества-кандидата (см. Рис. 1). К тому моменту, когда медицинский препарат уже можно назначать, большая часть доклинических данных о безопасности и результативности уже заменится данными клинических испытаний с участием пациентов. Однако в некоторых случаях, например, при изучении воздействия вещества-кандидата на развитие рака или репродуктивные функции, этические соображения могут препятствовать сбору данных с участием людей. В таких случаях при клиническом использовании новых препаратов необходимо будет руководствоваться доклиническими данными в течение более продолжительного периода времени. Однако постепенно эти данные также нужно будет заменить данными, полученными за этот период, например, в ходе постмаркетингового управления жизненным циклом и фармакологического надзора.
- Если в начале периода разработки доклинические данные являются наиболее значимыми, со временем клинические данные превосходят доклинические по этому параметру.
На рис. 1 отражена относительная важность и значимость доклинических данных в процессе разработки медицинских препаратов с течением времени. На данные доклинических исследований в начале процесса разработки полагаются больше, чем на клинические данные, однако в дальнейшем происходит обратное.
В идеальном варианте все опасения по безопасности, которые появились в процессе разработок, должны быть разрешены ко времени получения регистрационного свидетельства. Однако на момент подачи и оценки досье многие основания для опасений о безопасности могут по-прежнему оставаться нерешенными, в том числе канцерогенность, генотоксичность, генотоксичные примеси, репродуктивная токсичность и гепатотоксичность.
Этические соображения
Приемлемость использования животных в качестве моделей при оценке риска для людей и правила использования таких моделей для имитации сердечных заболеваний изложены в Хельсинкской декларации.4 Хельсинкская декларация обеспечивает этическое и научное обоснование для первого введения вещества-кандидата здоровым добровольцам. Кроме того, в Декларации говорится, что биомедицинские исследования должны основываться на полноценно проведенных экспериментах в лаборатории и над животными, а также глубоком знании научной литературы. При использовании животных для исследований необходимо обеспечивать их максимально хорошее самочувствие.
Доклинические исследования: полноценные прогнозные средства для проведения исследований на людях?
Раньше проблемы прогностической ценности доклинических исследований были связаны с фармакокинетикой, фармакодинамикой (результативностью) и аспектами безопасности для людей, которые сложно предсказать, располагая только доклиническими данными. Множество новых технологий, таких как компьютерное моделирование, фармакогеномика, биомаркера и новые дизайны исследований для проведения клинических испытаний сейчас стремительно развиваются, и каждая из этих технологий положительно влияет на прогностическую ценность доклинических исследований.
Дополнительные источники
- Хельсинкская декларация предлагается на английском, испанском и французском языках здесь Retrieved 13 July, 2021, from https://www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects/ (по состоянию на 23 сентября 2015 г.). а также на немецком, японском, португальском, чешском и венгерском языках здесь http://www.wma.net/en/20activities/10ethics/10helsinki/ (по состоянию на 23 сентября 2015 г.).
Справочная литература
- Adapted from Cook, D., Brown, D., Alexander, R., March, R., Morgan, P., Satterthwaite, G., & Pangalos, M. (2014). Lessons learned from the fate of AstraZeneca's drug pipeline: A five-dimensional framework. Nature Reviews Drug Discovery, 13, 419-431. doi:10.1038/nrd4309
- European Medicines Agency. (2015) Non-clinical guidelines. Retrieved 24 July, 2015, from http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_000083.jsp&mid=WC0b01ac0580027548
- International Conference on Harmonisation (2015). ICH Guidelines. Retrieved 24 July, 2015, from http://www.ich.org/products/guidelines.html
- World Medical Association. (2013) WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects. Retrieved 24 July, 2015, from http://www.wma.net/en/30publications/10policies/b3/
- Nieto-Guiterrez, M. (2011) Non-clinical Assessment Requirements. Brussels: European Medicines Agency. Retrieved 24 July, 2015, from http://www.ema.europa.eu/docs/en_GB/document_library/Presentation/2011/06/WC500107868.pdf
Приложения
- Презентация: Доклинические исследования
Size: 440,406 bytes, Format: .pptx
Презентация доклинического исследования лекарственных препаратов. В этой презентации описываются цели доклинического исследования, сопутствующие виды деятельности (в том числе производство необходимого активного вещества), виды доклинических исследований, особенности моделей заболеваний на животных, сроки, продолжительность и результаты доклинических исследований, которые могут стать причиной прекращения разработки исследуемого вещества.
A2-2.02.1-v1.3