Last update: 3 Agosto 2015
Introduzione
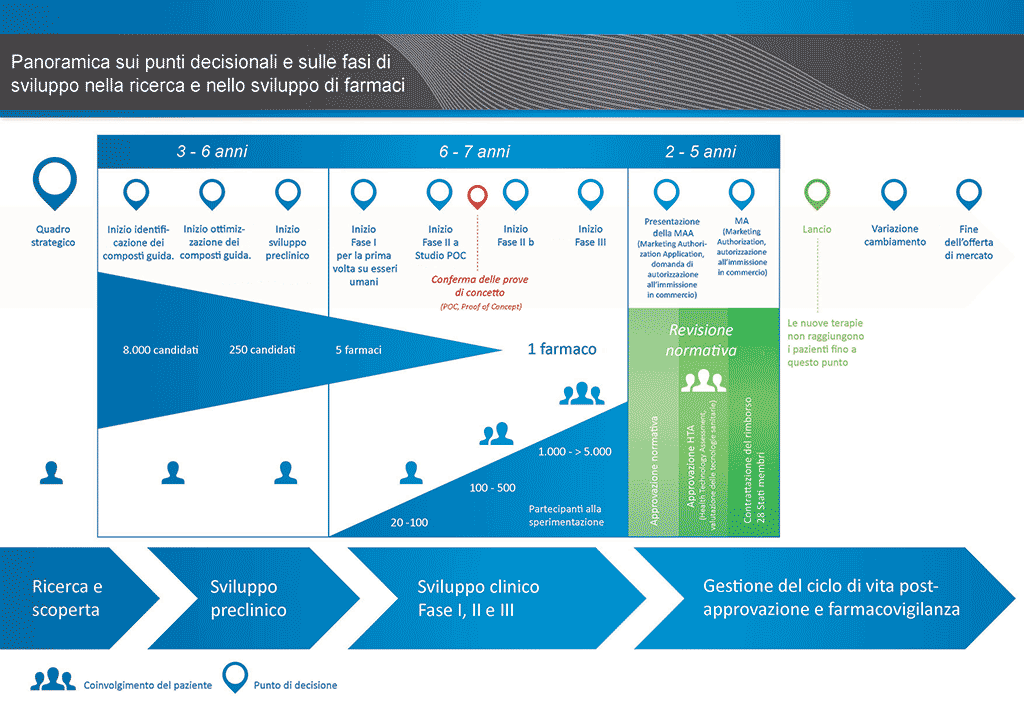
Sono necessari più di 12 anni e in media più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti.
Lo sviluppo di farmaci è un’impresa ad alto rischio. La maggioranza (circa il 98%) delle sostanze sviluppate non riesce ad arrivare sul mercato come nuovo medicinale. Ciò accade soprattutto perché osservando i benefici e i rischi (effetti collaterali negativi) riscontrati durante lo sviluppo, non sono comparabili positivamente rispetto ai farmaci già disponibili per i pazienti.
Lo sviluppo di un nuovo farmaco può essere suddiviso in 10 fasi diverse. Il seguente articolo si occupa della Fase 5: studi non clinici di sicurezza.
- Occorrono oltre 10 anni di attenta pianificazione e ricerca perché un farmaco passi da molecola a trattamento disponibile sul mercato.
Fase 5: studi non clinici di sicurezza.
È sicuro procedere con gli studi clinici? Questa fase del processo di sviluppo comprende studi sulla sicurezza in animali, che sono disciplinati da norme e regolamenti specifici di buona prassi di laboratorio (GLP, Good Laboratory Practice). Nessun candidato farmaco può essere studiato su esseri umani (in "studi clinici") prima che il suo profilo di sicurezza sia stato stabilito in studi sulla sicurezza in animali. Lo sviluppo di medicinali è strettamente controllato. La legge impone norme e regolamenti circa ciò che viene fatto e il modo in cui viene fatto.
Prima di effettuare il lavoro degli studi non clinici di sicurezza, devono essere prodotte quantità maggiori del composto candidato affinché siano svolti tutti gli appositi esami. Anche il processo di produzione deve seguire linee guida e normative severe chiamate buona prassi di fabbricazione (GMP, Good Manufacturing Practice).
Questi regolamenti affermano quali studi devono essere effettuati e quale tipo di animali deve essere utilizzato per ottenere informazioni valide. Essi comprendono l'osservazione degli effetti:
- nell'animale a livello globale
- in tutti i tessuti e organi animali (studi di tossicità sistemica)
- sulla capacità di riprodursi e di svilupparsi normalmente degli animali (studi di tossicità riproduttiva),
- sulla pelle o sugli occhi (studi di tossicità locale)
- qualsiasi allergia (studi sull'ipersensibilità)
- sui cromosomi e sui geni (studi di genotossicità)
- di qualsiasi tipo sulla formazione di tumori (studi di cancerogenicità).
Questi studi sono indicati di seguito.
Tipi di studi tossicologici
- Studi di tossicità sistemica
- Studi a dose singola
- Studi a dose ripetuta
- Studi di tossicità riproduttiva
- Studi sulla fertilità maschile
- Studi sulla riproduzione e lo sviluppo femminile
- Studi di tossicità locale
- Studi sull'ipersensibilità
- Studi di genotossicità
- Studi di carcinogenicità
Questi studi non solo mostrano il profilo di sicurezza negli animali, ma forniscono anche importanti informazioni circa:
- il modo in cui la sostanza entra nell'organismo (Assorbimento)
- la Distribuzione della sostanza nell'organismo
- la scomposizione della sostanza da parte dell'organismo (Metabolismo)
- il modo in cui la sostanza esce dall'organismo (Escrezione).
Ciò viene a volte abbreviato in "ADME".
Tutte queste informazioni sono utilizzate per decidere se il composto candidato può procedere al primo studio (clinico) su esseri umani e se sì, quali dosi utilizzare.
Per poter proseguire con gli studi clinici in esseri umani, il composto candidato deve avere mostrato un profilo di sicurezza accettabile in tutti gli studi tossicologici non clinici necessari. Tuttavia, non saranno stati ultimati tutti gli studi non clinici sulla sicurezza. Per esempio, studi di carcinogenicità a lungo termine richiedono in media due anni e proseguono contemporaneamente agli studi clinici.
Riferimenti bibliografici
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford, UK: Wiley-Blackwell.
Allegati
- Scheda informativa: scoperta di un farmaco
Size: 1,204,035 bytes, Format: .docx
Scoperta di un farmaco. Questa scheda informativa si occupa delle fasi della scoperta e del processo di sviluppo di farmaci che hanno luogo prima che un composto venga studiato in esseri umani, dalla pre-scoperta (raccolta d’informazioni su una malattia) a studi non clinici di sicurezza in animali.
- Presentazione: i principi di base relativi alla scoperta e allo sviluppo di farmaci
Size: 877,906 bytes, Format: .pptx
I principi di base relativi alla scoperta e allo sviluppo di farmaci. Sono necessari più di 12 anni e più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti. Questa presentazione spiega in dettaglio il percorso a partire dalla scoperta fino all’immissione sul mercato di un nuovo farmaco e oltre.
A2-1.02.4-v1.1