Last update: 8 lipca 2015
Biodostępność
Biodostępność określa się jako: ułamek (procent) podanej dawki niezmienionego leku, która osiąga krwiobieg (krążenie ogólne).
W każdym przypadku podawania leku pożądane jest, aby aktywna substancja leku określana także jako „aktywny składnik farmaceutyczny” (API) mogła dotrzeć do organizmu. Jednak wprowadzenie aktywnej substancji do organizmu nie wystarczy, aby osiągnąć efekt terapeutyczny. Substancja aktywna musi być dostępna w odpowiedniej dawce w tym miejscu organizmu, w którym ma działać. To konkretne miejsce określa się jako „miejsce docelowe”. Ponadto substancja aktywna musi dotrzeć do miejsca docelowego w pewnym czasie i musi być tam dostępna przez określony czas.
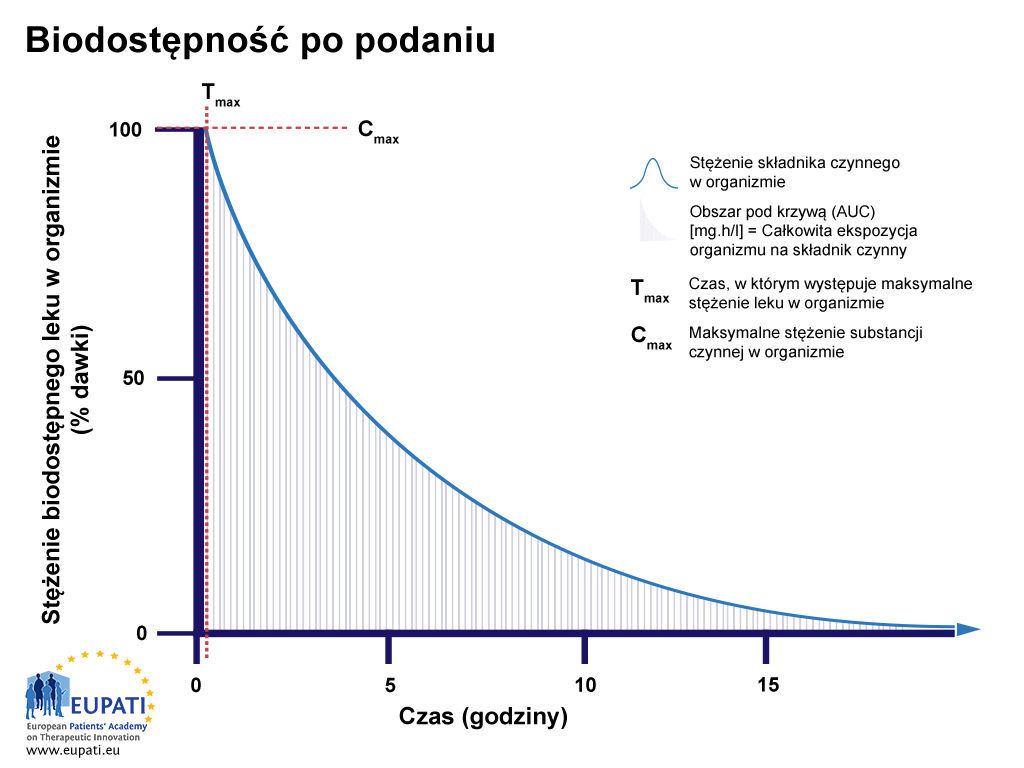
Przy bezpośrednim wstrzyknięciu do krwiobiegu, czyli przy wstrzyknięciu dożylnym, biodostępność określa się jako 100% (zob. rysunek poniżej).
- Procent substancji czynnej w organizmie po wstrzyknięciu bezpośrednio do krwiobiegu, badany w ciągu 15 godzin. Obszar pod krzywą (AUC) jest zacieniony. Tmaks. to czas, po którym lek osiąga najwyższe stężenie we krwi, natomiast Cmaks. to maksymalne stężenie leku oznaczone we krwi.
Po wstrzyknięciu substancja aktywna dociera do miejsca docelowego, odbywszy skomplikowaną drogę przez krwiobieg. Podczas oceniania biodostępności pobiera się próbki krwi i określa się stężenie substancji aktywnej we krwi (w krążeniu ogólnym). Wynika stąd, że biodostępność wyniesie 100% bezpośrednio po wstrzyknięciu, ponieważ substancja aktywna jest podawana bezpośrednio do krwi. Taka sytuacja jest przedstawiona na osi Y na rysunku powyżej (Biodostępność po podaniu dożylnym). Tak więc jeśli 75 miligramów (mg) substancji aktywnej zostanie wstrzyknięte do krwiobiegu, 100% odpowiada 75 mg substancji aktywnej.
Kiedy substancja aktywna krąży w krwiobiegu, zostaje częściowo zmetabolizowana lub wydalona, toteż jej stężenie we krwi zmniejsza się w przebiegu czasu (zob. rysunek powyżej). Profil biodostępności ocenia się i porównuje z innymi lekami, obserwując obszar pod krzywą (AUC), który przedstawia łączną wartość ekspozycji organizmu na substancję aktywną. Czas, po którym substancja aktywna osiąga maksymalne stężenie we krwi, określany jest jako Tmaks., a maksymalne stężenie tej substancji we krwi określa się jako Cmaks.
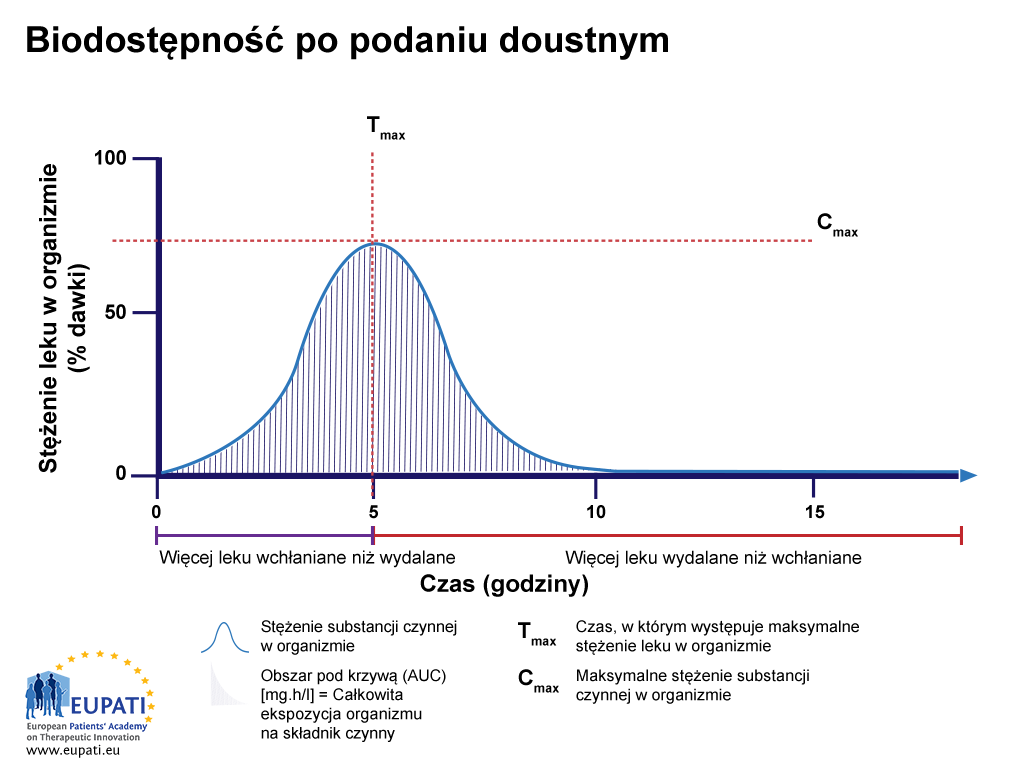
Jeśli substancja aktywna przedstawiona na rysunku powyżej zostanie podana inną drogą, na przykład doustnie jako tabletka, biodostępność jest niższa niż 100% (zob. rysunek poniżej: Biodostępność po podaniu doustnym).
- Procent substancji aktywnej po połknięciu tabletki, badany przez 15 godzin. Obszar AUC jest zacieniony. Tmaks. to czas, po którym lek osiąga najwyższe stężenie w krwiobiegu, natomiast Cmaks. to maksymalne stężenie leku oznaczone w krwiobiegu.
Biodostępność po podaniu doustnym
Procent substancji aktywnej po połknięciu tabletki, badany przez 15 godzin. Obszar AUC jest zacieniony. Tmaks. to czas, po którym lek osiąga najwyższe stężenie w krwiobiegu, natomiast Cmaks. to maksymalne stężenie leku oznaczone w krwiobiegu.
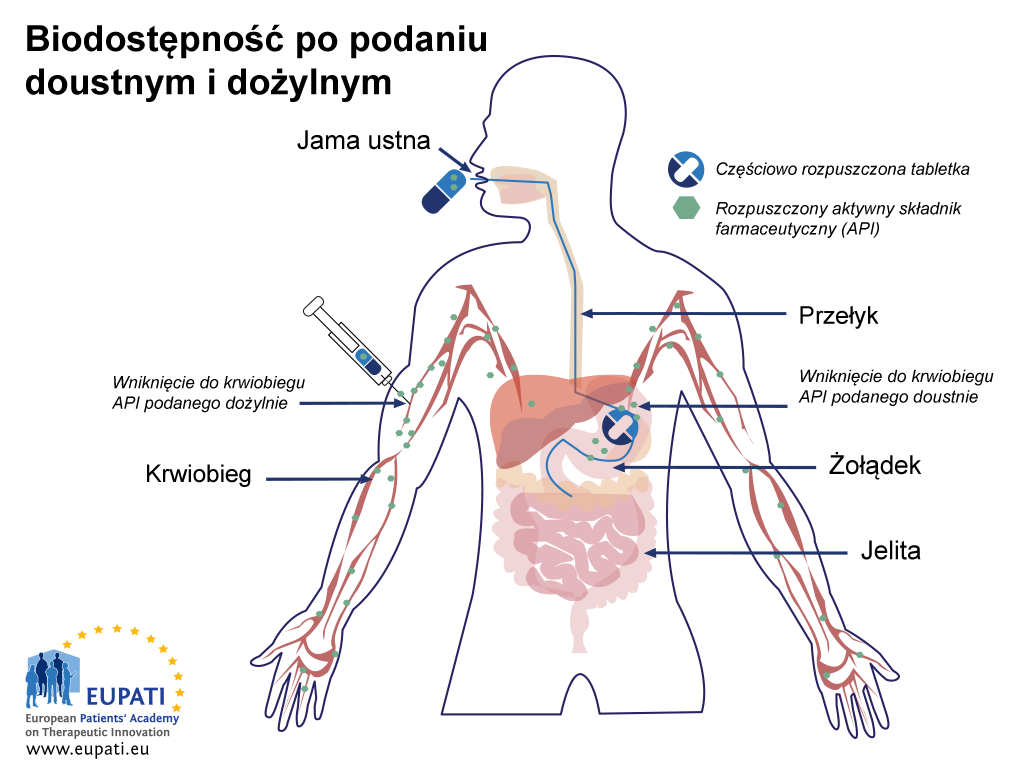
Niższa biodostępność po podaniu drogą doustną w porównaniu z biodostępnością po wstrzyknięciu jest objaśniona na rysunku poniżej (Biodostępność po podaniu ustnym i dożylnym):
- Schemat przedstawiający różnicę wchłaniania w przypadku kapusłki podanej doustnie a wstrzyknięciem bezpośrednio do krwiobiegu (wstrzyknięcie dożylne). Z żołądka kapsułka przechodzi do jelita cienkiego, gdzie ma miejsce kolejny etap wchłaniania.
Połknięta tabletka lub kapsułka trafia w ciągu jednej lub dwóch minut do żołądka.1 W żołądku dochodzi do rozpuszczenia tabletki lub kapsułki, a niektóre substancje aktywne są wchłaniane do krwiobiegu. Składniki są transportowane do jelita cienkiego, gdzie wchłanianie zostaje zakończone. Wchłanianie z przewodu pokarmowego może różnie przebiegać. Niższa biodostępność może wynikać ze słabego wchłaniania (lub jego braku) w żołądku i jelitach, więc ten etap może istotnie wpływać na dostępność leku.
Po wchłonięciu substancja aktywna najpierw trafia do żyły wrotnej wątroby, a następnie jest transportowana do wątroby. W tym momencie substancja aktywna jest po raz pierwszy metabolizowana w wątrobie, co określa się jako „metabolizm pierwszego przejścia”. Niektóre substancje aktywne są podczas pierwszego przejścia metabolizowane w większym stopniu niż inne. Niezmetabolizowana część substancji aktywnej, zwykle mniejsza niż 100%, przechodzi do krążenia ogólnego przez żyłę wątrobową. Rzeczywista ilość docierająca do krążenia ogólnego jest określana jako „biodostępność bezwzględna”.
Biodostępność bezwzględna stanowi porównanie biodostępności aktywnego składnika farmaceutycznego (API) w krążeniu ogólnym po podaniu drogą pozanaczyniową z biodostępnością tego samego leku po podaniu dożylnym. Jest to procent API wchłonięty w efekcie podania pozanaczyniowego w porównaniu z procentem tego samego leku wchłoniętym po podaniu dożylnym.
Mówiąc w skrócie, w przypadku biodostępności bezwzględnej normę stanowi zawsze podanie dożylne.
Biodostępność względna jest miarą biodostępności postaci (A) pewnego produktu medycznego w porównaniu z inną postacią (B) tego samego produktu medycznego, zwykle z ustanowioną normą przy podaniu pozanaczyniowym, lub po podaniu inną drogą.
Na biodostępność wpływają także różne inne czynniki, które są właściwe dla każdego człowieka. Dołączony arkusz informacyjny zawiera kilka przykładów biodostępności.
Biorównoważność
Biorównoważność jest relacją pomiędzy dwiema postaciami tego samego leku w tej samej dawce mającymi podobną biodostępność.
Biodostępność względna służy nie tylko do porównywania różnych postaci leku, ale także do porównywania dwóch produktów medycznych o tej samej postaci (np. tabletek) zawierających taką samą substancję aktywną, produkowanych przez różne firmy farmaceutyczne. Tabletka firmy A jest określana jako produkt generyczny w stosunku do referencyjnej tabletki firmy B (produkt markowy). Aby określić, czy tabletka A stanowi biorównoważnik tabletki B, porównuje się ich wartości biodostępności.2
Inne materiały
- Food and Drug Administation (2002). Guidance for industry: Bioavailability and bioequivalence studies for orally administered drug products – General considerations. Rockville, MD: Food and Drug Administration. Pobrano 23 czerwca 2015 r. ze strony http://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/AbbreviatedNewDrugApplicationANDAGenerics/UCM154838.pdf
- Wang, H., Li, Q., Reyes, S., Zhang, J., Xie, L., Melendez, V., Hickman, M. and Kozar, M.P. (2013). Formulation and particle size reduction improve bioavailability of poorly water-soluble compounds with antimalarial activity. Malaria Research and Treatment, Pobrano 23 czerwca 2015 r. ze strony http://dx.doi.org/10.1155/2013/769234
- Johnson, J.A. (2000). Predictability of the effects of race or ethnicity on pharmacokinetics of drugs. International Journal of Clinical Pharmacology and Therapeutics, 38, 53-60.
Piśmiennictwo
- Tatum, R.P., Shi, G., Manka, M.A., Brasseur, J.G., Joehl, R.J. and Kahrilas, P.J. (2000). Bolus transit assessed by an esophageal stress test in postfundoplication dysphagia. Journal of Surgical Research, 91, 56–60.
- MobiSystems, Inc. (2007). Dorland's Medical Dictionary for Health Consumers. [Mobile application software].
Załączniki
- Arkusz informacyjny: Przykłady biodostępności
Size: 100,611 bytes, Format: .docx
Przykłady biodostępności dotyczące penicyliny i astmy.
A2-1.16-V1.2