Last update: 19 November 2015
Einleitung
Toxizitätsstudien untersuchen das Sicherheitsprofil des Wirkstoffkandidaten. Zudem liefern sie wichtige Informationen zur Resorption, Distribution, Verstoffwechselung und Ausscheidung des Wirkstoffs im bzw. durch den Körper. Ein Wirkstoffkandidat muss in vielen verschiedenen Arten präklinischer Toxizitätsstudien beurteilt werden, bevor er dem ersten freiwilligen Probanden verabreicht werden kann; im Anschluss daran muss sogar eine noch größere Zahl von Toxizitätsstudien durchgeführt werden, bevor das Arzneimittel eine Marktzulassung erhält. Der folgende Artikel erkundet die verschiedenen Arten von Toxizitätsstudien, die möglicherweise in ein präklinisches Programm aufgenommen werden müssen.
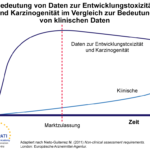
- Während der Entwicklung und nach der Marktzulassung erfahren Daten aus Studien zur Entwicklungstoxizität und Karzinogenität weiterhin größeres Vertrauen als klinische Daten.
Arten von Toxizitätsstudien
Im Rahmen der präklinischen Tests müssen die folgenden Arten von Toxizitätsstudien durchgeführt werden:
- Untersuchungen zur systemischen Toxizität
- Einzeldosis-Studien
- Mehrfachdosis-Studien
- Untersuchungen zur Reproduktionstoxizität
- Untersuchungen zur männlichen Fertilität
- Untersuchungen zur weiblichen Fertilität und zur Entwicklung der Leibesfrucht
- Untersuchungen zur lokalen Toxizität
- Untersuchungen zur Überempfindlichkeit
- Untersuchungen zur Genotoxizität
- Untersuchungen zur Karzinogenität
Diese werden in den nachstehenden Abschnitten der Reihe nach beschrieben.
Untersuchungen zur systemischen Toxizität
Untersuchungen zur systemischen Toxizität untersuchen das Toxizitätsprofil des Wirkstoffkandidaten in sämtlichen Geweben und Organen des Tiers. Untersuchungen zur systemischen Toxizität können als Einzeldosis- oder Mehrfachdosis-Studien durchgeführt werden.
Untersuchungen zur Reproduktionstoxizität
Untersuchungen zur Reproduktionstoxizität untersuchen die Auswirkungen des Wirkstoffkandidaten auf das Vermögen, sich fortzupflanzen und sich normal zu entwickeln. Diese Untersuchungen sollten unter Berücksichtigung der Population, die dem Wirkstoffkandidaten ausgesetzt sein wird, und unter Beachtung der folgenden Erwägungen durchgeführt werden:
- Männer können vor Durchführung der Untersuchungen zur männlichen Fertilität in klinische Phase-I- und Phase-II-Studien aufgenommen werden, da die Mehrfachdosis-Studien eine Evaluierung der männlichen Fortpflanzungsorgane beinhalten; dennoch sollten diese Untersuchungen nach Möglichkeit frühzeitig im Prozess durchgeführt werden. Auf jeden Fall sollte vor der Aufnahme klinischer Studien an großen Kollektiven oder von langer Dauer (z. B Phase-III-Studien) eine Untersuchung zur männlichen Fertilität durchgeführt und abgeschlossen werden.
- Nicht gebärfähige Frauen (beispielsweise nach einer irreversiblen Sterilisation oder nach der Menopause) können ohne Untersuchungen zur Reproduktionstoxizität in klinische Studien aufgenommen werden, sofern die maßgeblichen Mehrfachdosis-Studien (die eine Evaluierung der weiblichen Fortpflanzungsorgane beinhalten) durchgeführt wurden.
- Werden Frauen im gebärfähigen Alter als potenzielle Anwenderpopulation für das Arzneimittel identifiziert, müssen die Untersuchungen zur Reproduktionstoxizität so früh wie möglich durchgeführt werden.
Untersuchungen zur lokalen Toleranz
Untersuchungen zur lokalen Toleranz untersuchen die Wirkung des Wirkstoffs auf die Haut oder die Augen. Diese Untersuchungen zur lokalen Toxizität sind üblicherweise Bestandteil der Untersuchungen zur allgemeinen Toxizität. Zur Unterstützung der eingeschränkten Verabreichung an den Menschen über nicht-therapeutische Zugangswege (z. B. eine einzelne intravenös verabreichte Dosis für die Bestimmung der absoluten Bioverfügbarkeit) ist üblicherweise eine Einzeldosis-Untersuchung zur lokalen Toleranz bei einer einzelnen Spezies ausreichend.
Untersuchungen zur Genotoxizität
Untersuchungen zur Genotoxizität untersuchen die Auswirkungen des Wirkstoffkandidaten auf die Chromosomen und Gene und sind im Allgemeinen erforderlich, um die Sicherheit beim Menschen zu unterstützen. Die Beurteilung etwaiger Genmutationen wird für die Unterstützung aller klinischen Einzeldosis-Untersuchungen als ausreichend erachtet. Für klinische Mehrfachdosis-Untersuchungen ist eine zusätzliche Beurteilung etwaiger chromosomaler Schädigungen im Säugetiermodell erforderlich, und vor der Aufnahme von klinischen Phase-II-Studien sollte eine ganze Batterie von Untersuchungen auf Genotoxizität abgeschlossen werden. Ergeben die Untersuchungen zur Genotoxizität positive Befunde, muss die Notwendigkeit weiterer Untersuchungen in Betracht gezogen werden.
Untersuchungen zur Karzinogenität
Untersuchungen zur Karzinogenität beurteilen die Auswirkungen des Wirkstoffkandidaten auf die Entstehung von Krebs. Untersuchungen zur Karzinogenität werden im Allgemeinen zur Unterstützung des Antrags auf Marktzulassung eines neuen Arzneimittels durchgeführt. Gibt es jedoch einen relevanten Anlass für Bedenken, sollten Untersuchungen zu Karzinogenität durchgeführt werden, um die Sicherheit in den klinischen Studien zu untermauern. In diesem Fall kann eine längerfristig angelegte klinische Studie mit engmaschiger Überwachung durchgeführt werden. Im Allgemeinen können bei Arzneimitteln, die für die Behandlung schwerwiegender Erkrankungen bei erwachsenen oder pädiatrischen Patienten vorgesehen sind, unter Zugrundelegung der Annahme, dass der Vorteil einer frühzeitigen Verfügbarkeit des Arzneimittels für die Patienten das mögliche Risiko überwiegt, die Untersuchungen zur Karzinogenität nach der Zulassung erfolgen; es ist jedoch ratsam, diese so früh wie möglich durchzuführen.
Anlagen
- Präsentation: Nicht-klinische Entwicklung
Size: 396,736 bytes, Format: .pptx
Eine Präsentation zum nicht-klinischen Entwicklungsabschnitt eines Arzneimittels. Diese Präsentation behandelt Ziele der nicht-klinischen Entwicklung, Hintergrundaktivitäten (einschließlich der Herstellung des benötigten Wirkstoffs), Arten von nicht-klinischen Studien, spezifische Besonderheiten des Tiermodells, Abwägungen zum zeitlichen Ablauf und der Dauer sowie die nicht-klinischen Ergebnisse, die zu einer Einstellung der Entwicklung eines Wirkstoffkandidaten führen können.
A2-2.02.4-v1.3