Last update: 3 Agosto 2015
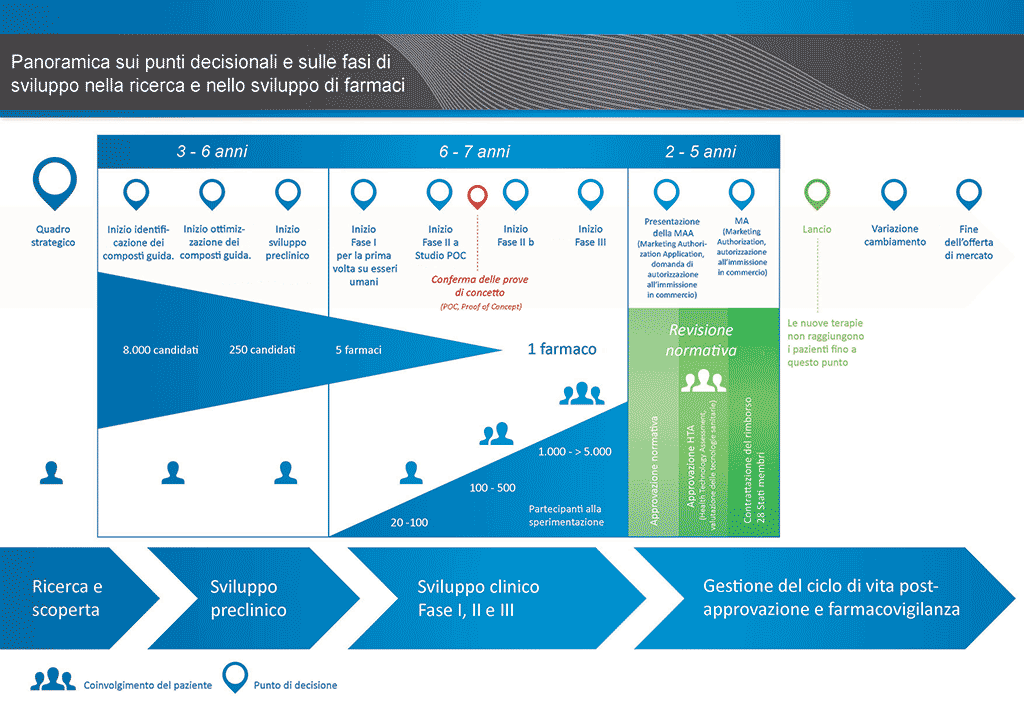
Sono necessari più di 12 anni e in media più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti.
Lo sviluppo di farmaci è un’impresa ad alto rischio. La maggioranza (circa il 98%) delle sostanze sviluppate non riesce ad arrivare sul mercato come nuovo medicinale. Ciò accade soprattutto perché i benefici e i rischi (effetti collaterali negativi) riscontrati durante lo sviluppo non sono comparabili positivamente rispetto ai farmaci già disponibili per i pazienti.
Lo sviluppo di un nuovo farmaco può essere suddiviso in 10 fasi diverse. Il seguente articolo si occupa della Fase 1: pre-scoperta.
- Occorrono oltre 10 anni di attenta pianificazione e ricerca perché un farmaco passi da molecola a trattamento disponibile sul mercato.
Fase 1: Pre-scoperta
Definizione di un "bisogno insoddisfatto". Nella fase di pre-scoperta, scienziati in accademia (università) e nell'industria (aziende farmaceutiche) lavorano per comprendere la malattia.
Bisogno insoddisfatto si riferisce al fatto che per una malattia:
- non vi è un farmaco adatto disponibile, oppure
- vi è un farmaco ma alcuni pazienti potrebbero avere effetti collaterali inaccettabili e non possono assumerlo.
Il processo di ricerca e di sviluppo utilizza molte risorse ed è costoso. Le aziende possono avviare un nuovo programma per un bisogno insoddisfatto solo se vi è un motivo economico per farlo. Ciò succede perché le aziende hanno bisogno di trarre profitti dal nuovo farmaco per pagare i costi di sviluppo e per investire in progetti per nuovi farmaci. Vi sono molti bisogni insoddisfatti per cui attualmente non sono sviluppati nuovi farmaci. I legislatori europei ne sono consapevoli e offrono incentivi e compensi per sostenere lo sviluppo di farmaci nei casi più difficili, ad esempio per bambini o pazienti con malattie rare.
Le fasi fondamentali nello sviluppo di farmaci sono indicate nel diagramma e spiegate ulteriormente nelle sezioni successive. Una fase importante, che deve essere superata con successo prima che il farmaco possa essere commercializzato (lanciato), è il processo di presentazione e approvazione della domanda d'immissione in commercio presso l'autorità di regolamentazione. Tuttavia, il successo di questo processo di approvazione non è nelle mani dell'azienda.
Ciascuna fase nel processo di sviluppo dei farmaci comprende il raggiungimento di un accordo riguardo ai fondi (investimento) e alle persone che svolgono il lavoro, vale a dire una "decisione d'investimento" (ID). I risultati di ciascuna fase sono quindi verificati prima che l'attività successiva abbia inizio. Questo modello di "decisione d'investimento – attività – risultati – decisione d'investimento" prosegue per l'intero processo di sviluppo. Ciò significa che se i risultati in ciascun stadio non sono soddisfacenti, il processo sarà interrotto. Le risorse finanziarie e le risorse umane possono quindi essere dirette ad altri progetti.
Riferimenti bibliografici
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Allegati
- Scheda informativa: scoperta di un farmaco
Size: 1,204,035 bytes, Format: .docx
Scoperta di un farmaco. Questa scheda informativa si occupa delle fasi della scoperta e del processo di sviluppo di farmaci che hanno luogo prima che un composto venga studiato in esseri umani, dalla pre-scoperta (raccolta d’informazioni su una malattia) a studi non clinici di sicurezza in animali.
- Presentazione: i principi di base relativi alla scoperta e allo sviluppo di farmaci
Size: 877,906 bytes, Format: .pptx
I principi di base relativi alla scoperta e allo sviluppo di farmaci. Sono necessari più di 12 anni e più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti. Questa presentazione spiega in dettaglio il percorso a partire dalla scoperta fino all’immissione sul mercato di un nuovo farmaco e oltre.
A2-1.02.1-V1.1