Last update: 4 August 2015
Einleitung
Es dauert über 12 Jahre und kostet durchschnittlich mehr als eine Milliarde Euro, all die Forschungs- und Entwicklungsarbeiten durchzuführen, die erforderlich sind, bis ein neues Arzneimittel für die Behandlung von Patienten zur Verfügung steht.
Arzneimittelentwicklung ist ein risikoreiches Geschäft. Der größte Teil (ca. 98 %) neu entwickelter Wirkstoffe schafft es nicht, als neues Arzneimittel auf den Markt zu gelangen. Das liegt daran, dass das Verhältnis zwischen dem Nutzen und den im Verlauf der Entwicklung festgestellten Risiken (schädliche Nebenwirkungen) dem Vergleich mit anderen, bereits für die Behandlung von Patienten verfügbaren Arzneimitteln meist nicht standhält.
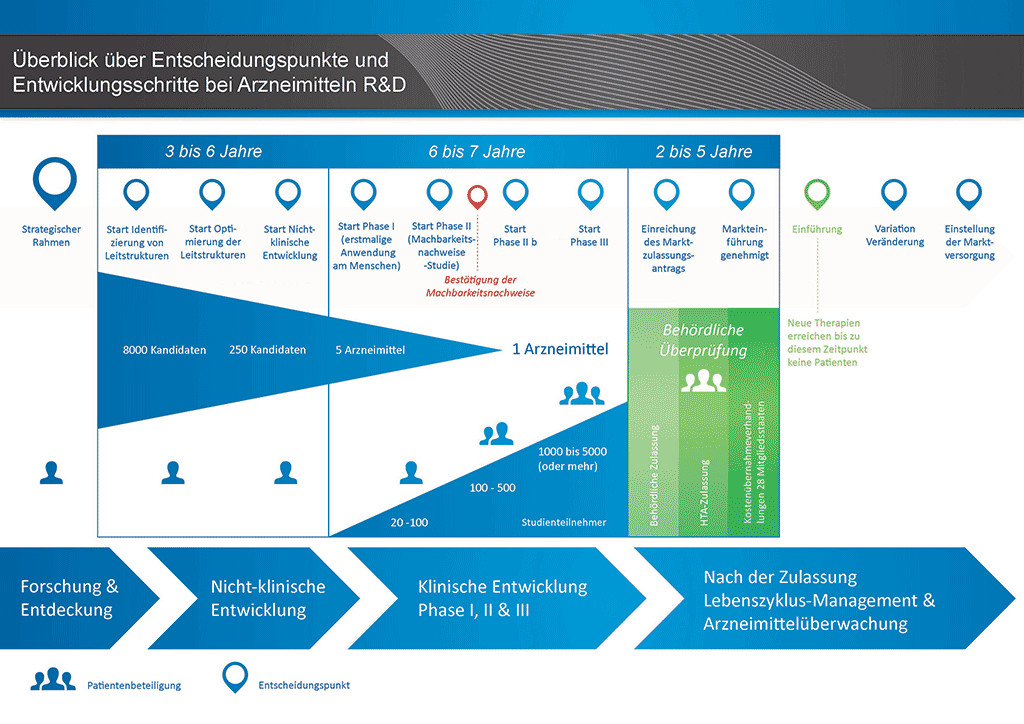
Die Entwicklung eines neuen Arzneimittels kann in zehn unterschiedliche Schritte unterteilt werden. Der folgende Artikel behandelt die Schritte 3 und 4: Generierung und Optimierung von Leitstrukturen
- Es benötigt mehr als 10 Jahre sorgfältiger Planung und Forschung, bis ein Arzneimittel sich vom Molekül zur marktfähigen Behandlung entwickelt hat.
Schritt 3: Generierung von Leitstrukturen
Dieser Schritt umfasst die Suche nach einem Molekül, das mit dem „Target“ interagiert. Das Molekül kann natürlichen Ursprungs (beispielsweise ein Teil einer Pflanze) oder eine künstlich hergestellte chemische Verbindung sein. Derartige Moleküle bezeichnet man als „niedermolekulare Verbindungen“. Hunderttausende von Molekülen werden getestet, um „Leitstrukturen“ – Moleküle, die mit dem „Target“ interagieren – zu finden. Testverfahren, die dazu dienen, Leitstrukturen zu identifizieren, nennt man Screeningverfahren. Moderne Robotertechnologie ermöglicht ein Hochdurchsatz-Screening. Dabei werden Millionen von Molekülen schnell getestet. Nachdem die Leitstrukturen generiert oder gefunden wurden, kann der Prozess zum nächsten Schritt übergehen.
Es ist auch möglich, hochmolekulare Verbindungen (Proteine) zu finden, die mit dem „Target“ interagieren. Diese hochmolekularen Verbindungen sind wesentlich aufwändiger herzustellen. Sie werden durch biotechnologische Prozesse hergestellt und daher als „Biologika“ bezeichnet. In der Biotechnologie werden die hochmolekularen Verbindungen von Wirtszellen eines lebenden Organismus (z. B. Bakterien, Hefen oder tierischen Zellen) in großen Bioreaktoren (Fermentern) produziert. Die Proteine werden dann separiert und gereinigt. Die gereinigten Proteine können dann genutzt werden, um Interaktionen mit dem „Target“ zu erforschen.
Traditionell hat die Pharmaindustrie „niedermolekulare Verbindungen“ produziert und diese zu neuen Arzneimitteln entwickelt. Heutzutage werden ebenso hochmolekulare Verbindungen (Proteine) oder „Biologika“ hergestellt. Sowohl niedermolekulare als auch hochmolekulare Verbindungen sind für die Arzneimittelentwicklung wichtig.
Schritt 4: Optimierung von Leitstrukturen
Bei der Optimierung von Leitstrukturen werden Modifikationen an den Molekülen vorgenommen, um ihre Wirkung zu verbessern. Das Screeningverfahren identifiziert „Leitstrukturen“ – Moleküle, die mit dem „Target“ interagieren. Diese Moleküle zeigen jedoch häufig nur eine schwache Wirkung und sind damit für eine weitere Entwicklung ungeeignet. Chemiker verändern daher das gewählte „Leitstruktur“-Molekül durch Hinzufügen oder Entfernen von Elementen. Dies schafft eine Anzahl geringfügig unterschiedlicher Moleküle. Das Molekül eines existierenden Arzneimittels könnte ebenfalls verändert werden, um dessen Wirkung zu verbessern oder zu verändern. Computertechnologie kann dabei helfen, diese Moleküle zu gestalten.
Diese modifizierten Moleküle werden dann getestet, um festzustellen, welche Struktur den höchsten Wirkungsgrad besitzt und besser vertragen wird (Sicherheit). Diese Untersuchungen helfen Wissenschaftlern, Einblicke in die Pharmakologie des Moleküls (das Verhalten des Moleküls im Körper) zu gewinnen. Die Moleküle mit höherem Wirkungsgrad und besserer Verträglichkeit können dann als Wirkstoffkandidat zu weiteren Testreihen vorrücken. Zu diesem Zeitpunkt werden normalerweise die den Wirkstoffkandidaten betreffenden wissenschaftlichen und technischen Informationen (z. B. seine Molekularstruktur und Wirkung) registriert oder patentiert, um als geistiges Eigentum geschützt zu werden.
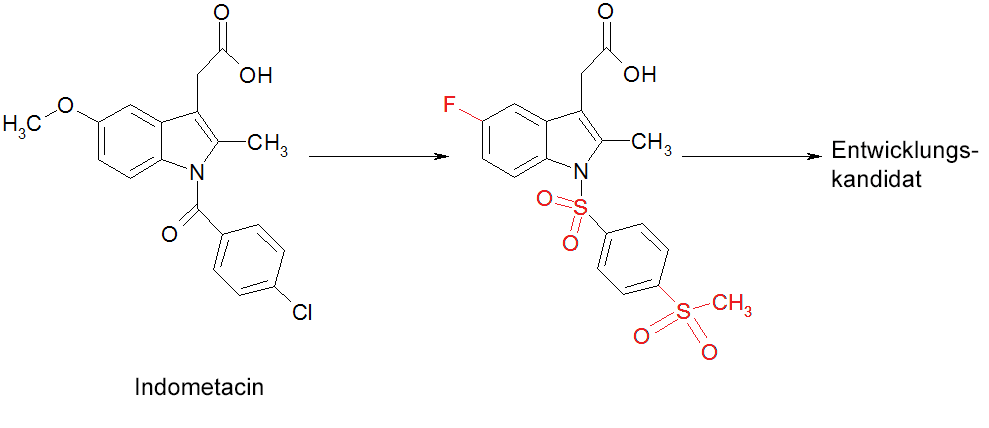
- Optimierung von Indometacin zu einem potenten CRTH2-Antagonisten. Das ursprüngliche Molekül auf der linken Seite (Indometacin) ist chemisch verändert worden (Änderungen in rot hervorgehoben), um es in einen Wirkstoffkandidaten für ein Entwicklungsprojekt zu verwandeln.
Wie schon erwähnt werden in jeder Phase des Entwicklungsprozesses die Ergebnisse einer Vielzahl von Versuchen überprüft. Auf Grundlage dieser Untersuchung muss dann entschieden werden, ob die Entwicklung fortgesetzt wird oder nicht. Bei einer positiven Entscheidung müssen weitere Investitionen zur Finanzierung der nächsten Versuchsreihe getätigt werden. Sprechen die bei den Experimenten erfassten Informationen jedoch gegen eine Fortsetzung des Entwicklungsprozesses, wird das Projekt gestoppt.
Zusammenfassung: Schritte 1 bis 4:
Ein „Wirkstoffkandidat“ zeigt sich nur, wenn das richtige „Target“ gewählt und die beste Leitstruktur-Verbindung identifiziert wurde. Bis zu diesem Stadium hat der Arzneimittelentdeckungsprozess
- im Mittel 4,5 Jahre gedauert,
- die Überprüfung einer großen Anzahl von Molekülen (5000 bis 10.000, bei niedermolekularen Verbindungen deutlich mehr) beinhaltet und
- im Mittel 500 Millionen Euro gekostet.
Bei dem Wirkstoffkandidaten kann sich um eine niedermolekulare oder um eine hochmolekulare Verbindung (Biologikum) handeln.
Quellenangaben
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Anlagen
- Datenblatt: Arzneimittelentdeckung
Size: 1,226,937 bytes, Format: .docx
Arzneimittelentdeckung. Dieses Datenblatt behandelt die Schritte des Arzneimittelentdeckungs- und -entwicklungsprozesses, die vor dem Test eines Wirkstoffs am Menschen stattfinden – von der Erkenntnisgewinnung (Sammeln von Informationen zu einer Erkrankung) bis hin zu den nichtklinischen Sicherheitstests im Tiermodell.
- Präsentation: Die grundlegenden Prinzipien der Arzneimittelentdeckung und -entwicklung
Size: 945,895 bytes, Format: .pptx
Die grundlegenden Prinzipien der Arzneimittelentdeckung und -entwicklung. Es dauert über 12 Jahre und kostet mehr als eine Milliarde Euro, all die Forschungs- und Entwicklungsarbeiten durchzuführen, die erforderlich sind, bis ein neues Arzneimittel für die Behandlung von Patienten zur Verfügung steht. Diese Präsentation stellt die Details des Prozesses von der Entdeckung bis zur Markteinführung eines neuen Arzneimittels und darüber hinaus vor.
A2-1.02.3-V1.1